Что такое таргетная терапия и в чем ее прорыв?
2
Содержание статьи
Во всем виноваты гены Первый прорыв Как это работает Возможности таргетной терапии Новые горизонты
Таргетная (от англ. target — «мишень»), или целевая, терапия воздействует на определенные молекулярные мишени в клетках. Традиционные методики лечения злокачественных опухолей, такие как химиотерапия, воздействуют на все делящиеся клетки. А таргетные препараты нацелены только на те молекулы, которые присутствуют в раковых клетках. Получается, что такие медикаменты бьют прямо в белки, которые как раз и участвуют в образовании опухоли¹. Чтобы целевая терапия заработала (и вообще родилась), нужно было интенсивно развивать отдельную научную область — молекулярную биологию, — представители которой исследовали в том числе и раковые клетки. Рассказываем, что же из этого вышло.
Во всем виноваты гены
Рак — мультифакторное заболевание. Оно может быть вызвано множеством причин, из-за которых в клетках накапливаются «поломки» генов, мутации, и запускается процесс образования опухоли (канцерогенез). Немецкий биолог Теодор Бовери первым предположил, что патологический рост клеток могут вызывать хромосомные нарушения². Между прочим, свои гипотезы Бовери выдвигал еще в начале XX века, хотя первые онкогены (гены, которые в результате мутаций приобретают свойство вызывать образование опухоли) были открыты значительно позже. Так, Фрэнсис Пейтон Раус уже в 1911 году описал вирус, передающий ген Scr, мутация в котором вызывала у цыплят образование опухоли соединительной ткани³. А доказательство существования протоонкогенов и открытие Scr было сделано Стивом Мартином в 1970 году⁴. Майкл Бишоп и Гарольд Вармус выдвинули теорию клеточного происхождения ретровирусных онкогенов через шесть лет, в 1976 году⁵. Это открытие позволило выдвинуть еще одно смелое предположение: все виды рака, а не только связанные с вирусами, могут быть вызваны мутациями, активирующими процесс образования опухоли. В 1989 году Бишоп и Вармус были удостоены Нобелевской премии за это революционное открытие — роль онкогенов в развитии рака⁶.
В 1982–1983 годах, ученые установили, что протоонкоген (ген, который еще не привел к образованию раковых клеток) ras, который есть и в нормальных клетках, может подвергаться мутациям и становиться онкогеном — именно его обнаруживали в клетках опухоли мочевого пузыря⁶.
Итак, если известно, что в некоторых случаях канцерогенез запускают онкогены, то, возможно, существует способ остановить процесс, воздействуя на них? Достаточно выяснить, что это за гены. Чтобы решить данную задачу и найти мутации, которые наиболее часто связаны с образованием опухолей, нужно изучить в среднем 2000 пар «опухоль — норма» для каждого гена. Получается, что для 50 видов рака нужно проанализировать около 100 000 пар⁷. Сегодня ученые вплотную занимаются этой задачей.
Первый прорыв
Одним из первых известных онкогенов стал HER2 — рецептор человеческого эпидермального фактора роста (белок, стимулирующий рост клеток и дифференцировку эпителиального покрова). Он был открыт Робертом Вайнбергом. Выяснилось, что увеличение числа копий этого гена связано с возникновением некоторых видов рака молочной железы. А еще это своеобразный маркер неблагоприятного течения заболевания.
Открытие гена HER2 было первым шагом к целевой терапии рака молочной железы. Идея была такая: необходимо создать лекарство на основе мышиных антител. Этот препарат останавливал бы работу белков, за синтез которых отвечает ген HER2. Тем самым рост и размножение опухолевых клеток блокируются⁸.
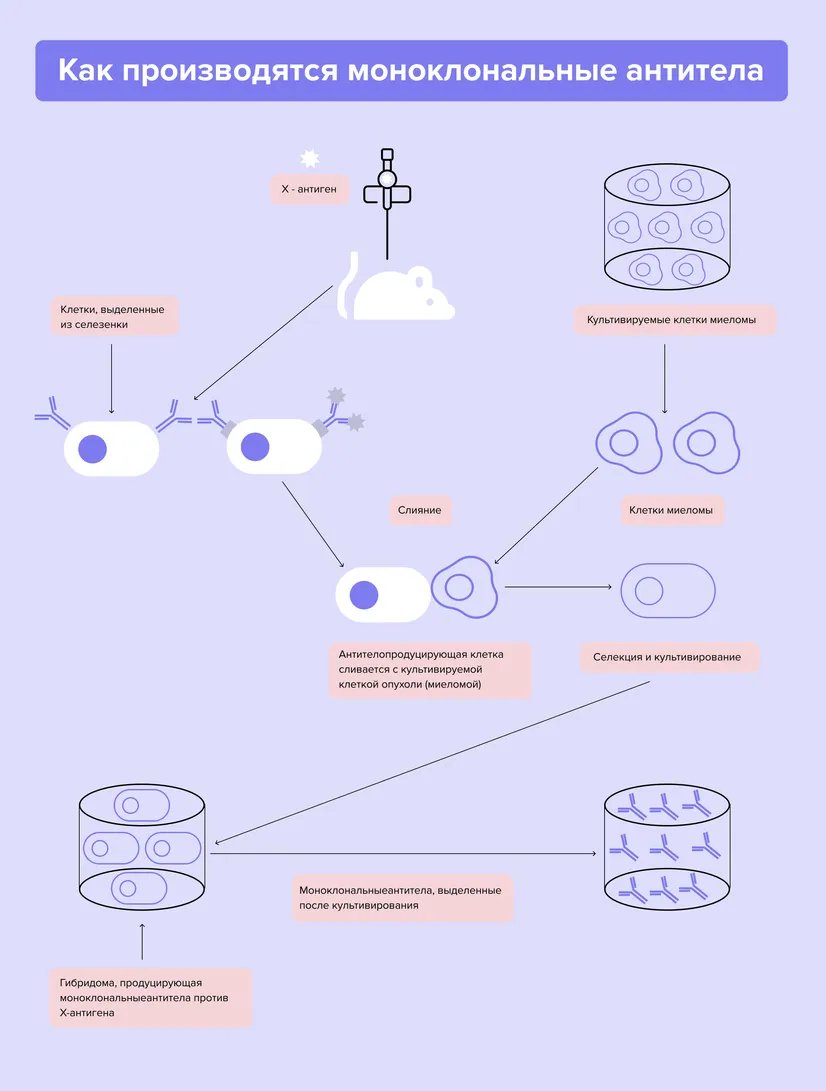
Моноклональные антитела — это специфические молекулы, которые иммунные клетки вырабатывают для защиты от чужеродных агентов (антигенов). Их получают при помощи иммунизации мышей и крыс. Клетки животных скрещивают с клетками миеломы - особого вида опухоли, которую выращивают при помощи специальных питательных сред. В результате образуются гибриды. Они, в свою очередь, вырабатывают антитела к нужному типу опухоли.
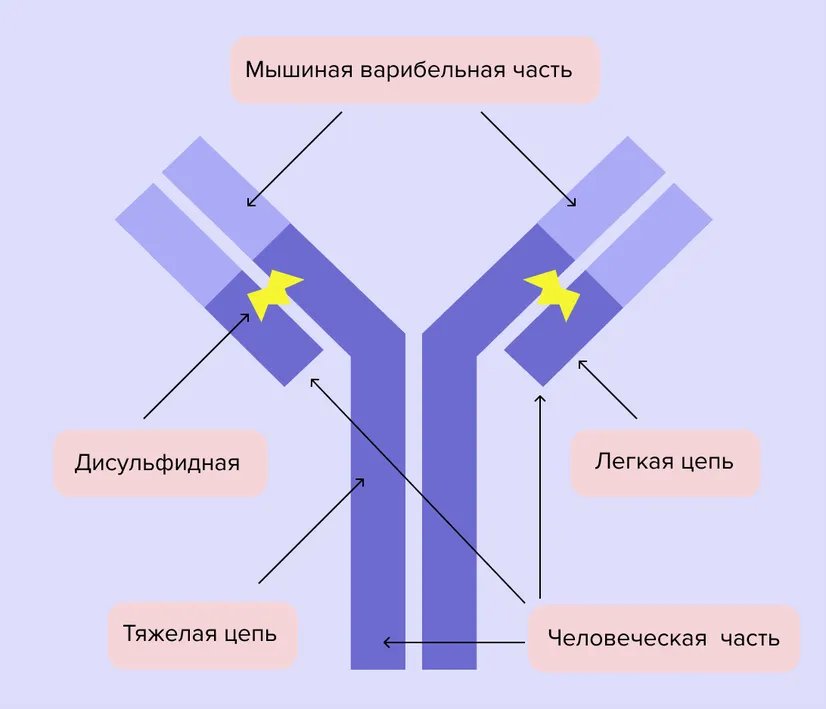
Перед исследователями стояла большая проблема — мышиные антитела сами по себе воспринимаются организмом враждебно. На помощь пришла генная инженерия. Ученые создали смешанные антитела, хуманизируя («очеловечивая») мышиные. Так появились первые таргетные препараты⁸.
Схема строения моноклонального антитела. Моноклональные антитела - сложные многоатомные структуры больших размеров
В 1991 году первой женщиной, получившей терапию с применением таргетного препарата, стала Барбара Кларк. У нее был диагностирован рак молочной железы с метастазами в легких. В 1998 году FDA (Food and Drug Administration — государственный орган, регулирующий лекарственный рынок в США) одобрило применение таргетных препаратов в комбинации с химиотерапией⁸. На сегодняшний день таргетная терапия используется в лечении многих видов рака. Например, она показана при немелкоклеточном раке легкого, также этот вид терапии используют при раке молочной железы, яичника, матки, простаты, кишечника, желудка, печени, почки, головы и шеи, меланоме.
Как это работает
Как и другие лекарственные препараты, таргетные средства взаимодействуют с определенными мишенями в организме. Но, в отличие от обычных веществ, их цели высокоспецифичны. К примеру, знакомый многим аспирин (ацетилсалициловая кислота) подавляет производство воспалительных агентов в организме, связываясь с ферментом циклооксигеназой и подавляя ее действие. Без этого фермента дальнейший путь химических превращений невозможен.
Но помимо лечебного действия иногда возникают и определенные побочные эффекты: язва желудка, желудочно-кишечное кровотечение и др. Препарат не обладает избирательным действием, т. е. обладает низкой селективностью.
Таргетные препараты взаимодействуют со своими мишенями. В этом случае цель — это специфические молекулы, которые участвуют в процессах деления злокачественных клеток⁹. Препараты блокируют передачу сигналов в опухолевую клетку, останавливая ее деление.
Возможности таргетной терапии
Сами таргетные препараты отличаются друг от друга по механизмам действия:
- «малые молекулы», которые блокируют активированные ферменты внутри опухолевой клетки;
- специфические антитела против опухолевых антигенов.
Механизм, по сути, един — избирательное выведение раковых клеток с определенными биологическими характеристиками. Учитывая особенности таргетных препаратов, их применение возможно только в случае наличия специфических мишеней в опухолевых клетках¹⁰. Чтобы создать эффективно действующий таргетный препарат, нужно точно выяснить, что именно играет ключевую роль в цепочке канцерогенеза у конкретного пациента.
Благодаря таргетной терапии открылись широкие возможности лечения не только солидных опухолей, но и онкогематологических заболеваний. К примеру, пятилетняя выживаемость при миелолейкозе увеличилась до 84–93%, а десятилетняя выживаемость, которая раньше не превышала 5%, теперь равна 40–80%⁹. Появилась реальная возможность продлить стабилизацию опухолевого процесса¹⁰.
Новые горизонты
Новыми горизонтами диагностики являются введение в рутинную клиническую практику методов секвенирования нового поколения (NGS), появление программы TCGA (The Cancer Genome Atlas), вирусные векторы в составе генной терапии.
Уже сегодня на основе секвенирования нового поколения создан инновационный метод диагностики — комплексное геномное профилирование, которое дает возможность в рамках одного биоматериала обнаружить все возможные генетические изменения в онкозначимых генах. Результатом тестирования является отчет, в котором врачу предоставляется подробная информация о найденных мутациях и возможностях таргетной терапии, с учетом уникальной характеристики опухоли10. Подробнее о методе в нашей статье.
Активное развитие таргетной терапии изменило представление ученых о характере самой болезни. Внедрение в клиническую практику таргетных препаратов значительно улучшило результаты лечения некоторых групп пациентов со злокачественными опухолями11. А ведь многие из них считались устойчивыми к существующей химиотерапии и имели крайне неблагоприятный прогноз. Таргетная терапия — один из важных шагов на пути к персонализированному лечению.
M-RU-00008433 Декабрь 2022
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Хвастунов Р. А., Скрыпникова Г. В., Усачев А. А. Таргетная терапия в онкологии. Лекарственный вестник. 2014;4(56):3–10.
Hansford S., Huntsman D.G. Boveri at 100: Theodor Boveri and Genetic Predisposition To Cancer. J Pathol. 2014. DOI: 10.1002/path.4414.
Rous P. A sarcoma of the fowl transmissible by an agent separable from the tumor cells. J. Exp. Med. 1911; 13: 397–399.
Martin G. S. Rous sarcoma virus: a function required for the maintenanceof the transformed state. Nature 1970; 227: 1021–1023.
Stehelin D., Varmus H. Е., Bishop J. M., Vogt P. K. DNA related to transforming gene(s) of avian sarcoma viruses is present in normal avian DNA. Nature 1976; 260: 170–173.
Javier R.T., Butel J.S. The history of tumor virology. Cancer Res. 2008;68(19):7693–7706. DOI: 10.1158/0008-5472.CAN-08-3301.
Lawrence M. S., Stojanov P., Mermel C. H. et al. Discovery and saturation analysis of cancer genes across 21 tumour types. Nature. 2014;505(7484):495–501. DOI: 10.1038/nature12912.
Biba E. The her2 journey. Genetech. gene.com/stories/her2/ (дата обращения: 02.09.2020).
Бесова Н.С. продолжительность терапии герцептином при her2-позитивном раке молочной железы. Эффективная фармакотерапия. 2012;34:14–20.
Foundation medicine: For Patients https://www.foundationmedicine.com/info/detail/for-patients (дата обращения 01.08.2022)
Переводчикова Н.И. Таргетные препараты и их место в современной терапии опухолевых заболеваний. Клиническая онкогематология. 2009;4:367–373.
Рак — мультифакторное заболевание. Оно может быть вызвано множеством причин, из-за которых в клетках накапливаются «поломки» генов, мутации, и запускается процесс образования опухоли (канцерогенез). Немецкий биолог Теодор Бовери первым предположил, что патологический рост клеток могут вызывать хромосомные нарушения². Между прочим, свои гипотезы Бовери выдвигал еще в начале XX века, хотя первые онкогены (гены, которые в результате мутаций приобретают свойство вызывать образование опухоли) были открыты значительно позже. Так, Фрэнсис Пейтон Раус уже в 1911 году описал вирус, передающий ген Scr, мутация в котором вызывала у цыплят образование опухоли соединительной ткани³. А доказательство существования протоонкогенов и открытие Scr было сделано Стивом Мартином в 1970 году⁴. Майкл Бишоп и Гарольд Вармус выдвинули теорию клеточного происхождения ретровирусных онкогенов через шесть лет, в 1976 году⁵. Это открытие позволило выдвинуть еще одно смелое предположение: все виды рака, а не только связанные с вирусами, могут быть вызваны мутациями, активирующими процесс образования опухоли. В 1989 году Бишоп и Вармус были удостоены Нобелевской премии за это революционное открытие — роль онкогенов в развитии рака⁶.
В 1982–1983 годах, ученые установили, что протоонкоген (ген, который еще не привел к образованию раковых клеток) ras, который есть и в нормальных клетках, может подвергаться мутациям и становиться онкогеном — именно его обнаруживали в клетках опухоли мочевого пузыря⁶.
Итак, если известно, что в некоторых случаях канцерогенез запускают онкогены, то, возможно, существует способ остановить процесс, воздействуя на них? Достаточно выяснить, что это за гены. Чтобы решить данную задачу и найти мутации, которые наиболее часто связаны с образованием опухолей, нужно изучить в среднем 2000 пар «опухоль — норма» для каждого гена. Получается, что для 50 видов рака нужно проанализировать около 100 000 пар⁷. Сегодня ученые вплотную занимаются этой задачей.
Одним из первых известных онкогенов стал HER2 — рецептор человеческого эпидермального фактора роста (белок, стимулирующий рост клеток и дифференцировку эпителиального покрова). Он был открыт Робертом Вайнбергом. Выяснилось, что увеличение числа копий этого гена связано с возникновением некоторых видов рака молочной железы. А еще это своеобразный маркер неблагоприятного течения заболевания.
Открытие гена HER2 было первым шагом к целевой терапии рака молочной железы. Идея была такая: необходимо создать лекарство на основе мышиных антител. Этот препарат останавливал бы работу белков, за синтез которых отвечает ген HER2. Тем самым рост и размножение опухолевых клеток блокируются⁸.
Моноклональные антитела — это специфические молекулы, которые иммунные клетки вырабатывают для защиты от чужеродных агентов (антигенов). Их получают при помощи иммунизации мышей и крыс. Клетки животных скрещивают с клетками миеломы - особого вида опухоли, которую выращивают при помощи специальных питательных сред. В результате образуются гибриды. Они, в свою очередь, вырабатывают антитела к нужному типу опухоли.
Перед исследователями стояла большая проблема — мышиные антитела сами по себе воспринимаются организмом враждебно. На помощь пришла генная инженерия. Ученые создали смешанные антитела, хуманизируя («очеловечивая») мышиные. Так появились первые таргетные препараты⁸.
Схема строения моноклонального антитела. Моноклональные антитела - сложные многоатомные структуры больших размеров
В 1991 году первой женщиной, получившей терапию с применением таргетного препарата, стала Барбара Кларк. У нее был диагностирован рак молочной железы с метастазами в легких. В 1998 году FDA (Food and Drug Administration — государственный орган, регулирующий лекарственный рынок в США) одобрило применение таргетных препаратов в комбинации с химиотерапией⁸. На сегодняшний день таргетная терапия используется в лечении многих видов рака. Например, она показана при немелкоклеточном раке легкого, также этот вид терапии используют при раке молочной железы, яичника, матки, простаты, кишечника, желудка, печени, почки, головы и шеи, меланоме.
Как это работает
Как и другие лекарственные препараты, таргетные средства взаимодействуют с определенными мишенями в организме. Но, в отличие от обычных веществ, их цели высокоспецифичны. К примеру, знакомый многим аспирин (ацетилсалициловая кислота) подавляет производство воспалительных агентов в организме, связываясь с ферментом циклооксигеназой и подавляя ее действие. Без этого фермента дальнейший путь химических превращений невозможен.
Но помимо лечебного действия иногда возникают и определенные побочные эффекты: язва желудка, желудочно-кишечное кровотечение и др. Препарат не обладает избирательным действием, т. е. обладает низкой селективностью.
Таргетные препараты взаимодействуют со своими мишенями. В этом случае цель — это специфические молекулы, которые участвуют в процессах деления злокачественных клеток⁹. Препараты блокируют передачу сигналов в опухолевую клетку, останавливая ее деление.
Возможности таргетной терапии
Сами таргетные препараты отличаются друг от друга по механизмам действия:
- «малые молекулы», которые блокируют активированные ферменты внутри опухолевой клетки;
- специфические антитела против опухолевых антигенов.
Механизм, по сути, един — избирательное выведение раковых клеток с определенными биологическими характеристиками. Учитывая особенности таргетных препаратов, их применение возможно только в случае наличия специфических мишеней в опухолевых клетках¹⁰. Чтобы создать эффективно действующий таргетный препарат, нужно точно выяснить, что именно играет ключевую роль в цепочке канцерогенеза у конкретного пациента.
Благодаря таргетной терапии открылись широкие возможности лечения не только солидных опухолей, но и онкогематологических заболеваний. К примеру, пятилетняя выживаемость при миелолейкозе увеличилась до 84–93%, а десятилетняя выживаемость, которая раньше не превышала 5%, теперь равна 40–80%⁹. Появилась реальная возможность продлить стабилизацию опухолевого процесса¹⁰.
Новые горизонты
Новыми горизонтами диагностики являются введение в рутинную клиническую практику методов секвенирования нового поколения (NGS), появление программы TCGA (The Cancer Genome Atlas), вирусные векторы в составе генной терапии.
Уже сегодня на основе секвенирования нового поколения создан инновационный метод диагностики — комплексное геномное профилирование, которое дает возможность в рамках одного биоматериала обнаружить все возможные генетические изменения в онкозначимых генах. Результатом тестирования является отчет, в котором врачу предоставляется подробная информация о найденных мутациях и возможностях таргетной терапии, с учетом уникальной характеристики опухоли10. Подробнее о методе в нашей статье.
Активное развитие таргетной терапии изменило представление ученых о характере самой болезни. Внедрение в клиническую практику таргетных препаратов значительно улучшило результаты лечения некоторых групп пациентов со злокачественными опухолями11. А ведь многие из них считались устойчивыми к существующей химиотерапии и имели крайне неблагоприятный прогноз. Таргетная терапия — один из важных шагов на пути к персонализированному лечению.
M-RU-00008433 Декабрь 2022
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Хвастунов Р. А., Скрыпникова Г. В., Усачев А. А. Таргетная терапия в онкологии. Лекарственный вестник. 2014;4(56):3–10.
Hansford S., Huntsman D.G. Boveri at 100: Theodor Boveri and Genetic Predisposition To Cancer. J Pathol. 2014. DOI: 10.1002/path.4414.
Rous P. A sarcoma of the fowl transmissible by an agent separable from the tumor cells. J. Exp. Med. 1911; 13: 397–399.
Martin G. S. Rous sarcoma virus: a function required for the maintenanceof the transformed state. Nature 1970; 227: 1021–1023.
Stehelin D., Varmus H. Е., Bishop J. M., Vogt P. K. DNA related to transforming gene(s) of avian sarcoma viruses is present in normal avian DNA. Nature 1976; 260: 170–173.
Javier R.T., Butel J.S. The history of tumor virology. Cancer Res. 2008;68(19):7693–7706. DOI: 10.1158/0008-5472.CAN-08-3301.
Lawrence M. S., Stojanov P., Mermel C. H. et al. Discovery and saturation analysis of cancer genes across 21 tumour types. Nature. 2014;505(7484):495–501. DOI: 10.1038/nature12912.
Biba E. The her2 journey. Genetech. gene.com/stories/her2/ (дата обращения: 02.09.2020).
Бесова Н.С. продолжительность терапии герцептином при her2-позитивном раке молочной железы. Эффективная фармакотерапия. 2012;34:14–20.
Foundation medicine: For Patients https://www.foundationmedicine.com/info/detail/for-patients (дата обращения 01.08.2022)
Переводчикова Н.И. Таргетные препараты и их место в современной терапии опухолевых заболеваний. Клиническая онкогематология. 2009;4:367–373.
Как и другие лекарственные препараты, таргетные средства взаимодействуют с определенными мишенями в организме. Но, в отличие от обычных веществ, их цели высокоспецифичны. К примеру, знакомый многим аспирин (ацетилсалициловая кислота) подавляет производство воспалительных агентов в организме, связываясь с ферментом циклооксигеназой и подавляя ее действие. Без этого фермента дальнейший путь химических превращений невозможен.
Но помимо лечебного действия иногда возникают и определенные побочные эффекты: язва желудка, желудочно-кишечное кровотечение и др. Препарат не обладает избирательным действием, т. е. обладает низкой селективностью.
Таргетные препараты взаимодействуют со своими мишенями. В этом случае цель — это специфические молекулы, которые участвуют в процессах деления злокачественных клеток⁹. Препараты блокируют передачу сигналов в опухолевую клетку, останавливая ее деление.
Сами таргетные препараты отличаются друг от друга по механизмам действия:
- «малые молекулы», которые блокируют активированные ферменты внутри опухолевой клетки;
- специфические антитела против опухолевых антигенов.
Механизм, по сути, един — избирательное выведение раковых клеток с определенными биологическими характеристиками. Учитывая особенности таргетных препаратов, их применение возможно только в случае наличия специфических мишеней в опухолевых клетках¹⁰. Чтобы создать эффективно действующий таргетный препарат, нужно точно выяснить, что именно играет ключевую роль в цепочке канцерогенеза у конкретного пациента.
Благодаря таргетной терапии открылись широкие возможности лечения не только солидных опухолей, но и онкогематологических заболеваний. К примеру, пятилетняя выживаемость при миелолейкозе увеличилась до 84–93%, а десятилетняя выживаемость, которая раньше не превышала 5%, теперь равна 40–80%⁹. Появилась реальная возможность продлить стабилизацию опухолевого процесса¹⁰.
Новые горизонты
Новыми горизонтами диагностики являются введение в рутинную клиническую практику методов секвенирования нового поколения (NGS), появление программы TCGA (The Cancer Genome Atlas), вирусные векторы в составе генной терапии.
Уже сегодня на основе секвенирования нового поколения создан инновационный метод диагностики — комплексное геномное профилирование, которое дает возможность в рамках одного биоматериала обнаружить все возможные генетические изменения в онкозначимых генах. Результатом тестирования является отчет, в котором врачу предоставляется подробная информация о найденных мутациях и возможностях таргетной терапии, с учетом уникальной характеристики опухоли10. Подробнее о методе в нашей статье.
Активное развитие таргетной терапии изменило представление ученых о характере самой болезни. Внедрение в клиническую практику таргетных препаратов значительно улучшило результаты лечения некоторых групп пациентов со злокачественными опухолями11. А ведь многие из них считались устойчивыми к существующей химиотерапии и имели крайне неблагоприятный прогноз. Таргетная терапия — один из важных шагов на пути к персонализированному лечению.
M-RU-00008433 Декабрь 2022
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Хвастунов Р. А., Скрыпникова Г. В., Усачев А. А. Таргетная терапия в онкологии. Лекарственный вестник. 2014;4(56):3–10.
Hansford S., Huntsman D.G. Boveri at 100: Theodor Boveri and Genetic Predisposition To Cancer. J Pathol. 2014. DOI: 10.1002/path.4414.
Rous P. A sarcoma of the fowl transmissible by an agent separable from the tumor cells. J. Exp. Med. 1911; 13: 397–399.
Martin G. S. Rous sarcoma virus: a function required for the maintenanceof the transformed state. Nature 1970; 227: 1021–1023.
Stehelin D., Varmus H. Е., Bishop J. M., Vogt P. K. DNA related to transforming gene(s) of avian sarcoma viruses is present in normal avian DNA. Nature 1976; 260: 170–173.
Javier R.T., Butel J.S. The history of tumor virology. Cancer Res. 2008;68(19):7693–7706. DOI: 10.1158/0008-5472.CAN-08-3301.
Lawrence M. S., Stojanov P., Mermel C. H. et al. Discovery and saturation analysis of cancer genes across 21 tumour types. Nature. 2014;505(7484):495–501. DOI: 10.1038/nature12912.
Biba E. The her2 journey. Genetech. gene.com/stories/her2/ (дата обращения: 02.09.2020).
Бесова Н.С. продолжительность терапии герцептином при her2-позитивном раке молочной железы. Эффективная фармакотерапия. 2012;34:14–20.
Foundation medicine: For Patients https://www.foundationmedicine.com/info/detail/for-patients (дата обращения 01.08.2022)
Переводчикова Н.И. Таргетные препараты и их место в современной терапии опухолевых заболеваний. Клиническая онкогематология. 2009;4:367–373.
Новыми горизонтами диагностики являются введение в рутинную клиническую практику методов секвенирования нового поколения (NGS), появление программы TCGA (The Cancer Genome Atlas), вирусные векторы в составе генной терапии.
Уже сегодня на основе секвенирования нового поколения создан инновационный метод диагностики — комплексное геномное профилирование, которое дает возможность в рамках одного биоматериала обнаружить все возможные генетические изменения в онкозначимых генах. Результатом тестирования является отчет, в котором врачу предоставляется подробная информация о найденных мутациях и возможностях таргетной терапии, с учетом уникальной характеристики опухоли10. Подробнее о методе в нашей статье.
Активное развитие таргетной терапии изменило представление ученых о характере самой болезни. Внедрение в клиническую практику таргетных препаратов значительно улучшило результаты лечения некоторых групп пациентов со злокачественными опухолями11. А ведь многие из них считались устойчивыми к существующей химиотерапии и имели крайне неблагоприятный прогноз. Таргетная терапия — один из важных шагов на пути к персонализированному лечению.
M-RU-00008433 Декабрь 2022
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Список литературы
Хвастунов Р. А., Скрыпникова Г. В., Усачев А. А. Таргетная терапия в онкологии. Лекарственный вестник. 2014;4(56):3–10.
Hansford S., Huntsman D.G. Boveri at 100: Theodor Boveri and Genetic Predisposition To Cancer. J Pathol. 2014. DOI: 10.1002/path.4414.
Rous P. A sarcoma of the fowl transmissible by an agent separable from the tumor cells. J. Exp. Med. 1911; 13: 397–399.
Martin G. S. Rous sarcoma virus: a function required for the maintenanceof the transformed state. Nature 1970; 227: 1021–1023.
Stehelin D., Varmus H. Е., Bishop J. M., Vogt P. K. DNA related to transforming gene(s) of avian sarcoma viruses is present in normal avian DNA. Nature 1976; 260: 170–173.
Javier R.T., Butel J.S. The history of tumor virology. Cancer Res. 2008;68(19):7693–7706. DOI: 10.1158/0008-5472.CAN-08-3301.
Lawrence M. S., Stojanov P., Mermel C. H. et al. Discovery and saturation analysis of cancer genes across 21 tumour types. Nature. 2014;505(7484):495–501. DOI: 10.1038/nature12912.
Biba E. The her2 journey. Genetech. gene.com/stories/her2/ (дата обращения: 02.09.2020).
Бесова Н.С. продолжительность терапии герцептином при her2-позитивном раке молочной железы. Эффективная фармакотерапия. 2012;34:14–20.
Foundation medicine: For Patients https://www.foundationmedicine.com/info/detail/for-patients (дата обращения 01.08.2022)
Переводчикова Н.И. Таргетные препараты и их место в современной терапии опухолевых заболеваний. Клиническая онкогематология. 2009;4:367–373.