Разбираемся, как исследование РНК помогает в диагностике сложных генетических нарушений при саркомах и гемобластозах.
Что такое анализ ДНК и РНК, и как его используют при онкологических заболеваниях
2
Содержание статьи
Как реализуется наследственная информация, закодированная в генах Как связаны ген и белок Как проходит исследование ДНК Чем отличаются ДНК и РНК Какие данные можно получить при секвенировании РНК Комбинированное секвенирование ДНК и РНК при гемобластозах и саркомах
В конце XX века с появлением химиотерапии и других методов лечения онкологических заболеваний перед врачами всегда возникала одна и та же загадка, почему два пациента, имеющие схожие симптомы и строение опухоли по-разному отвечают на лечение. Только после того, как выяснилось, что злокачественные опухоли возникают и развиваются из-за генетических нарушений, стало понятно, что заболевания могут различаться на генетическом уровне1.
В случае с гемобластозами и саркомами диагностика становится особенно сложной, поскольку количество генетических изменений, приводящих к бесконтрольному делению клеток, чрезвычайно велико. На сегодняшний день описано более 100 видов сарком, различающихся по течению и методам лечения2. Для точного определения типа опухоли и назначения эффективной терапии врачи используют сложные и дорогостоящие диагностические методы, включая анализы ДНК и РНК3,4. В этой статье говорим о том, как генетические исследования дополняют друг друга и помогают врачам выбирать лечение.
Саркомы — группа злокачественных опухолей, развивающихся из соединительной ткани. Они могут поражать кости, хрящи, жировую, мышечную ткани, сосуды и т. д.5
Гемобластозы — онкологические заболевания, поражающие лимфатические узлы, костный мозг и клетки крови. К ним относятся лимфомы и лейкозы6.
Как реализуется наследственная информация, закодированная в генах
Вся информация о строении нашего организма, работе каждого органа содержится в ДНК. В ней есть участки — гены, в которых описано, какие белки и в каком количестве должны вырабатываться в определенной клетке. Чтобы представить, как «инструкции» ДНК реализуются в клетках, рассмотрим процесс формирования цвета волос. У брюнетов в клетках волосяной луковицы образуется большое количество черного пигмента — эумиелина. За это отвечает белок MC1R. Информация о строении этого белка находится в гене MC1R. Если из-за особенностей наследования этот ген будет неактивен, снизится количество белка и вырабатываемого им эумиелина. У человека с таким набором генов волосы будут светлыми.
Как связаны ген и белок
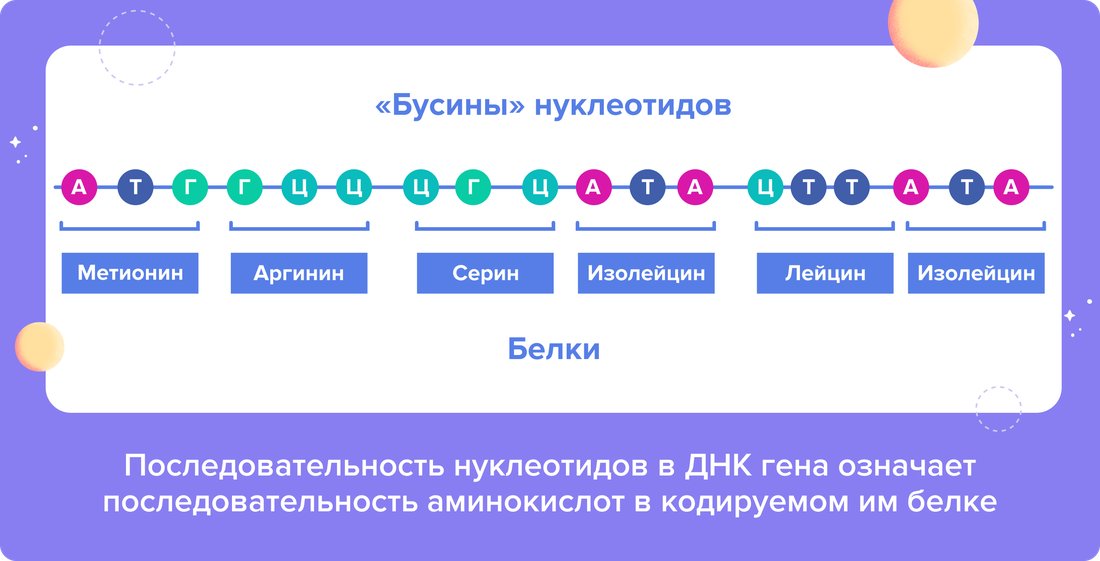
ДНК представляет собой длинную нить, построенную из миллиардов «бусин» — нуклеотидов. Всего существует 4 вида нуклеотидов в зависимости от азотистых оснований в их составе: аденина (А), тимина (Т), гуанина (Г) или цитозина (Ц). Участок ДНК, кодирующий определенный белок, называется геном. По сути эта последовательность является схемой-проектом, чертежом будущего белка. Сочетание трех «бусин» нуклеотидов означает одну из 20 аминокислот, из которых строится белковая цепочка8.
Как проходит исследование ДНК
ДНК — это многотомное собрание информации, содержащее данные о каждом признаке и особенности нашего организма. Обнаружить изменения в ДНК можно несколькими способами. Некоторые типичные и часто встречающиеся генетические нарушения известны врачам заранее. Например, саркома Юинга развивается, когда участок хромосомы 22 случайно сливается с участком хромосомы 11, что запускает неконтролируемое деление клеток2. Эта мутация хорошо изучена, и существуют стандартные диагностические наборы для её выявления.
Но представим ситуацию, что никакого слияния 11 и 22 хромосомы не обнаружено, все остальные стандартные тесты также не показали результата. Тогда врачам приходится проверять множество генов, связанных с заболеванием, чтобы обнаружить ошибку. Этот процесс, называемый полногеномным секвенированием, сложен и похож на поиск иголки в стоге сена.
Ситуация с лимфомами и геобластозами осложняется тем, что по сравнению с другими онкологическими заболеваниями, количество возможных изменений намного больше, из-за чего требуется применять дополнительные методы диагностики.
Чем отличаются ДНК и РНК
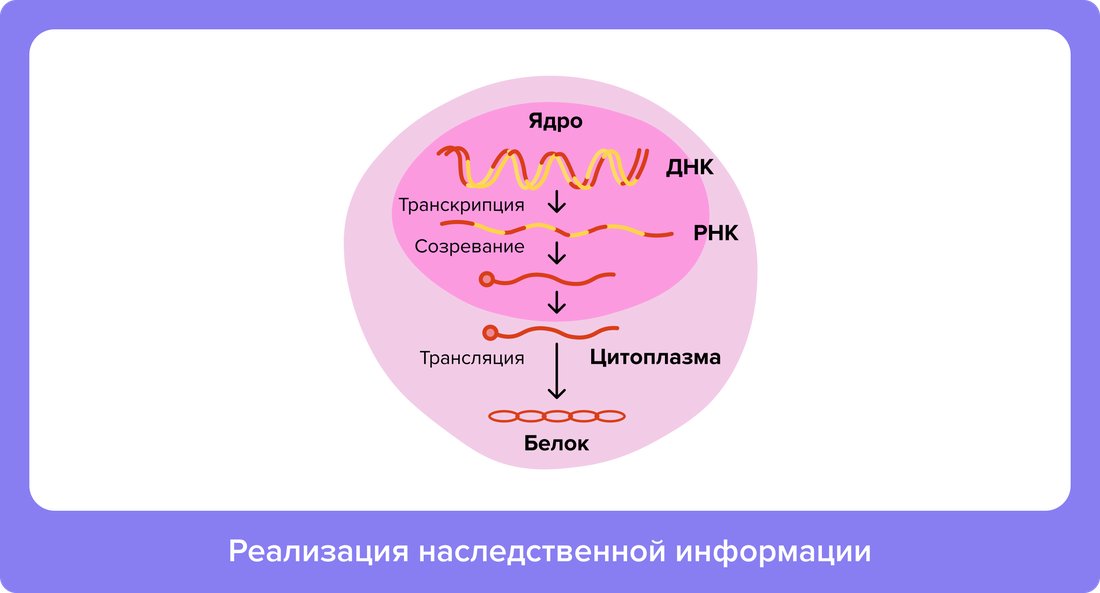
Молекулы ДНК хранятся в ядре клетки. Это своеобразный «сейф», стенки которого защищают наследственную информацию от ферментов и активных химических веществ, образующихся в результате жизнедеятельности клетки9. Построение белков, наоборот, происходит в активной зоне — цитозоле, где «кипят» химические реакции. Чтобы преодолеть эти барьеры, требуется посредник — матричная РНК (мРНК).
Молекула мРНК по химической структуре похожа на ДНК, она также состоит из последовательности нуклеотидов. Процесс ее образования можно описать как перенос информации о строении одного гена с большого носителя — ДНК — на мобильный носитель, который будет в дальнейшем использоваться для построения белка. После копирования мРНК не сразу отправляется для синтеза белка, она проходит стадию процессинга (созревания). В это время из нее удаляется ненужная для построения белка информация, добавляется «сопроводительная документация», помогающая мРНК выйти из ядра, формируется финальный «чертеж», по которому будет строиться белок8.
Какие данные можно получить при секвенировании РНК
Если мРНК повторяет гены ДНК, то встает вопрос, зачем исследовать маленькие копии, если можно сразу посмотреть весь первоисточник. Однако секвенирование РНК значительно расширяет понимание генетических нарушений, метод позволяет получить следующую информацию:
Выявить значимые изменения. В ДНК одной клетки одновременно могут существовать сотни мутаций, и теоретически все их мы можем найти, сделав полногеномное секвенирование. Но, оказывается, не вся информация с ДНК переносится на мРНК, из-за чего большинство этих мутаций никак не отразится на жизни клетки. Полученные таким образом данные никак не повлияют на дальнейшее лечение. Исследуя мРНК, мы, напротив, сразу анализируем только значимые изменения, которые скопировались с ДНК и в дальнейшем приведут к синтезу дефектного белка.
Обнаружить новые типы заболеваний. Благодаря тому, что секвенирование РНК выявляет значимые генетические изменения, его результаты помогают с большей точностью выявлять новые и редкие мутации9, 10.
Найти ошибки процессинга. Генетические механизмы заболеваний могут быть чрезвычайно сложными. Причина изменения структуры белка может заключаться не в мутации гена, а в нарушении созревания мРНК. Процессинг происходит уже после создания копии гена и включает в себя более 150 модификаций нити РНК, в результате которых создается финальная матрица для синтеза белка. Нарушение на любом этапе может приводить к появлению дефектной матрицы мРНК и в дальнейшем к изменению белка11.
К недостаткам секвенирования РНК можно отнести его сложность. Молекулы нестабильны и могут разрушаться во время анализа, что снижает точность результата12.
Комбинированное секвенирование ДНК и РНК при гемобластозах и саркомах
Гемобластозы и саркомы возникают из-за разнообразных мутаций, включая потерю, вставку и замену нуклеотидов в составе гена, хромосомные перестройки и т. д. Особенно сложны с точки зрения диагностики перестройки. При них участок в цепи ДНК переезжает на новое место рядом с нехарактерным для него геном и изменяет его функцию. При саркомах врачи выявили 44 гена, слияние которых важно для диагностики и дальнейшего лечения4.
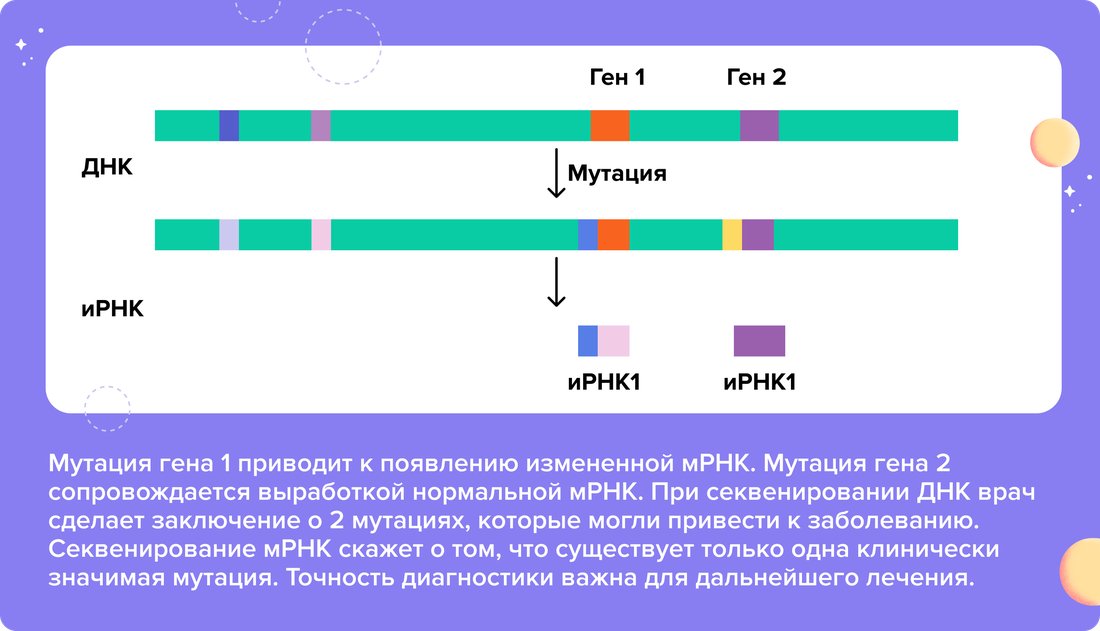
Обнаружить мутации можно, секвенируя молекулу ДНК. Генетик расшифрует интересующие гены, сверит их строение с базами данных и сделает заключение о нарушениях. Но когда речь заходит о редких или новых мутациях, сделать это становится сложнее. Приходится анализировать большие участки ДНК, исследовать расположение миллиардов нуклеотидов, что требует сложных вычислений. Кроме того, не все изменения ДНК имеют клиническую значимость. Даже если произошла перестройка в ДНК, ее копия мРНК может оставаться без изменений. Поэтому при этих заболеваниях анализ РНК может помочь врачам провести более точную диагностику.
- При секвенировании мРНК необходимо анализировать не всю огромную молекулу ДНК, а только копии, которые были сняты с нее. Это облегчает выявление редких и новых мутаций.
- Метод помогает избежать ошибок диагностики, поскольку показывает только перестройки, которые привели к изменениям в молекуле мРНК4.
В целом исследование РНК дополняет анализ ДНК, что используют для поиска сложных и редких генетических нарушений и выбора наиболее подходящего метода лечения.
MC-RU-01342 февраль 2025
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
McAleer S. A history of cancer and its treatment: Presidential Address to the Ulster Medical Society. 7th October 2021. Ulster Med J. 2022 Sep;91(3):124—129.
Pei J., Zhao X., Patchefsky A. S. Clinical application of RNA sequencing in sarcoma diagnosis: An institutional experience. Medicine (Baltimore). 2019 Jun;98(25):e16031. DOI: 10.1097/MD.0000000000016031.
He J., Abdel-Wahab O., Nahas M. K. et al. Integrated genomic DNA/RNA profiling of hematologic malignancies in the clinical setting. Blood. 2016 Jun 16;127(24):3004—3014. DOI: 10.1182/blood-2015-08-664649.
Huang X., Li G., Li L. et al. Establishing an RNA fusions panel in soft tissue sarcoma with clinical validation. Sci Rep. 2023 Mar 16;13(1):4403. DOI: 10.1038/s41598-023-29511-1.
Popovich J. R., Kashyap S., Gasalberti D. P., Cassaro S. Sarcoma. 2023 Aug 14. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan—. PMID: 30137818.
Abdulmawjood B., Roma-Rodrigues C., Fernandes A. R, Baptista P. V. Liquid biopsies in myeloid malignancies. Cancer Drug Resist. 2019 Dec 19;2(4):1044—1061. DOI: 10.20517/cdr.2019.88.
Morgan M. D., Pairo-Castineira E., Rawlik K. et al. Genome-wide study of hair colour in UK Biobank explains most of the SNP heritability. Nat Commun. 2018 Dec 10;9(1):5271. DOI: 10.1038/s41467-018-07691-z.
Alberts B., Johnson A., Lewis J. et al. Molecular biology of the cell. 4th edn. February 2003 Annals of Botany. 91(3):401. DOI:10.1093/aob/mcg023.
Fabrini R., Bocedi A., Pallottini V. et al. Nuclear shield: a multi-enzyme task-force for nucleus protection. PLoS One. 2010 Dec 10;5(12):e14125. DOI: 10.1371/journal.pone.0014125. PMID: 21170318; PMCID: PMC3000810.
El-Deiry W. S., Goldberg R. M., Lenz H. J. et al. The current state of molecular testing in the treatment of patients with solid tumors, 2019. CA Cancer J Clin. 2019 Jul;69(4):305—343. DOI: 10.3322/caac.21560.
Tsimberidou A. M., Fountzilas E., Bleris L., Kurzrock R. Transcriptomics and solid tumors: The next frontier in precision cancer medicine. Semin Cancer Biol. 2022 Sep;84:50-59. DOI: 10.1016/j.semcancer.2020.09.007.
Lu W., Zhou Q., Chen Y. Impact of RNA degradation on next-generation sequencing transcriptome data. Genomics. 2022 Jul;114(4):110429. DOI: 10.1016/j.ygeno.2022.110429.
Вся информация о строении нашего организма, работе каждого органа содержится в ДНК. В ней есть участки — гены, в которых описано, какие белки и в каком количестве должны вырабатываться в определенной клетке. Чтобы представить, как «инструкции» ДНК реализуются в клетках, рассмотрим процесс формирования цвета волос. У брюнетов в клетках волосяной луковицы образуется большое количество черного пигмента — эумиелина. За это отвечает белок MC1R. Информация о строении этого белка находится в гене MC1R. Если из-за особенностей наследования этот ген будет неактивен, снизится количество белка и вырабатываемого им эумиелина. У человека с таким набором генов волосы будут светлыми.
ДНК представляет собой длинную нить, построенную из миллиардов «бусин» — нуклеотидов. Всего существует 4 вида нуклеотидов в зависимости от азотистых оснований в их составе: аденина (А), тимина (Т), гуанина (Г) или цитозина (Ц). Участок ДНК, кодирующий определенный белок, называется геном. По сути эта последовательность является схемой-проектом, чертежом будущего белка. Сочетание трех «бусин» нуклеотидов означает одну из 20 аминокислот, из которых строится белковая цепочка8.
Как проходит исследование ДНК
ДНК — это многотомное собрание информации, содержащее данные о каждом признаке и особенности нашего организма. Обнаружить изменения в ДНК можно несколькими способами. Некоторые типичные и часто встречающиеся генетические нарушения известны врачам заранее. Например, саркома Юинга развивается, когда участок хромосомы 22 случайно сливается с участком хромосомы 11, что запускает неконтролируемое деление клеток2. Эта мутация хорошо изучена, и существуют стандартные диагностические наборы для её выявления.
Но представим ситуацию, что никакого слияния 11 и 22 хромосомы не обнаружено, все остальные стандартные тесты также не показали результата. Тогда врачам приходится проверять множество генов, связанных с заболеванием, чтобы обнаружить ошибку. Этот процесс, называемый полногеномным секвенированием, сложен и похож на поиск иголки в стоге сена.
Ситуация с лимфомами и геобластозами осложняется тем, что по сравнению с другими онкологическими заболеваниями, количество возможных изменений намного больше, из-за чего требуется применять дополнительные методы диагностики.
Чем отличаются ДНК и РНК
Молекулы ДНК хранятся в ядре клетки. Это своеобразный «сейф», стенки которого защищают наследственную информацию от ферментов и активных химических веществ, образующихся в результате жизнедеятельности клетки9. Построение белков, наоборот, происходит в активной зоне — цитозоле, где «кипят» химические реакции. Чтобы преодолеть эти барьеры, требуется посредник — матричная РНК (мРНК).
Молекула мРНК по химической структуре похожа на ДНК, она также состоит из последовательности нуклеотидов. Процесс ее образования можно описать как перенос информации о строении одного гена с большого носителя — ДНК — на мобильный носитель, который будет в дальнейшем использоваться для построения белка. После копирования мРНК не сразу отправляется для синтеза белка, она проходит стадию процессинга (созревания). В это время из нее удаляется ненужная для построения белка информация, добавляется «сопроводительная документация», помогающая мРНК выйти из ядра, формируется финальный «чертеж», по которому будет строиться белок8.
Какие данные можно получить при секвенировании РНК
Если мРНК повторяет гены ДНК, то встает вопрос, зачем исследовать маленькие копии, если можно сразу посмотреть весь первоисточник. Однако секвенирование РНК значительно расширяет понимание генетических нарушений, метод позволяет получить следующую информацию:
Выявить значимые изменения. В ДНК одной клетки одновременно могут существовать сотни мутаций, и теоретически все их мы можем найти, сделав полногеномное секвенирование. Но, оказывается, не вся информация с ДНК переносится на мРНК, из-за чего большинство этих мутаций никак не отразится на жизни клетки. Полученные таким образом данные никак не повлияют на дальнейшее лечение. Исследуя мРНК, мы, напротив, сразу анализируем только значимые изменения, которые скопировались с ДНК и в дальнейшем приведут к синтезу дефектного белка.
Обнаружить новые типы заболеваний. Благодаря тому, что секвенирование РНК выявляет значимые генетические изменения, его результаты помогают с большей точностью выявлять новые и редкие мутации9, 10.
Найти ошибки процессинга. Генетические механизмы заболеваний могут быть чрезвычайно сложными. Причина изменения структуры белка может заключаться не в мутации гена, а в нарушении созревания мРНК. Процессинг происходит уже после создания копии гена и включает в себя более 150 модификаций нити РНК, в результате которых создается финальная матрица для синтеза белка. Нарушение на любом этапе может приводить к появлению дефектной матрицы мРНК и в дальнейшем к изменению белка11.
К недостаткам секвенирования РНК можно отнести его сложность. Молекулы нестабильны и могут разрушаться во время анализа, что снижает точность результата12.
Комбинированное секвенирование ДНК и РНК при гемобластозах и саркомах
Гемобластозы и саркомы возникают из-за разнообразных мутаций, включая потерю, вставку и замену нуклеотидов в составе гена, хромосомные перестройки и т. д. Особенно сложны с точки зрения диагностики перестройки. При них участок в цепи ДНК переезжает на новое место рядом с нехарактерным для него геном и изменяет его функцию. При саркомах врачи выявили 44 гена, слияние которых важно для диагностики и дальнейшего лечения4.
Обнаружить мутации можно, секвенируя молекулу ДНК. Генетик расшифрует интересующие гены, сверит их строение с базами данных и сделает заключение о нарушениях. Но когда речь заходит о редких или новых мутациях, сделать это становится сложнее. Приходится анализировать большие участки ДНК, исследовать расположение миллиардов нуклеотидов, что требует сложных вычислений. Кроме того, не все изменения ДНК имеют клиническую значимость. Даже если произошла перестройка в ДНК, ее копия мРНК может оставаться без изменений. Поэтому при этих заболеваниях анализ РНК может помочь врачам провести более точную диагностику.
- При секвенировании мРНК необходимо анализировать не всю огромную молекулу ДНК, а только копии, которые были сняты с нее. Это облегчает выявление редких и новых мутаций.
- Метод помогает избежать ошибок диагностики, поскольку показывает только перестройки, которые привели к изменениям в молекуле мРНК4.
В целом исследование РНК дополняет анализ ДНК, что используют для поиска сложных и редких генетических нарушений и выбора наиболее подходящего метода лечения.
MC-RU-01342 февраль 2025
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
McAleer S. A history of cancer and its treatment: Presidential Address to the Ulster Medical Society. 7th October 2021. Ulster Med J. 2022 Sep;91(3):124—129.
Pei J., Zhao X., Patchefsky A. S. Clinical application of RNA sequencing in sarcoma diagnosis: An institutional experience. Medicine (Baltimore). 2019 Jun;98(25):e16031. DOI: 10.1097/MD.0000000000016031.
He J., Abdel-Wahab O., Nahas M. K. et al. Integrated genomic DNA/RNA profiling of hematologic malignancies in the clinical setting. Blood. 2016 Jun 16;127(24):3004—3014. DOI: 10.1182/blood-2015-08-664649.
Huang X., Li G., Li L. et al. Establishing an RNA fusions panel in soft tissue sarcoma with clinical validation. Sci Rep. 2023 Mar 16;13(1):4403. DOI: 10.1038/s41598-023-29511-1.
Popovich J. R., Kashyap S., Gasalberti D. P., Cassaro S. Sarcoma. 2023 Aug 14. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan—. PMID: 30137818.
Abdulmawjood B., Roma-Rodrigues C., Fernandes A. R, Baptista P. V. Liquid biopsies in myeloid malignancies. Cancer Drug Resist. 2019 Dec 19;2(4):1044—1061. DOI: 10.20517/cdr.2019.88.
Morgan M. D., Pairo-Castineira E., Rawlik K. et al. Genome-wide study of hair colour in UK Biobank explains most of the SNP heritability. Nat Commun. 2018 Dec 10;9(1):5271. DOI: 10.1038/s41467-018-07691-z.
Alberts B., Johnson A., Lewis J. et al. Molecular biology of the cell. 4th edn. February 2003 Annals of Botany. 91(3):401. DOI:10.1093/aob/mcg023.
Fabrini R., Bocedi A., Pallottini V. et al. Nuclear shield: a multi-enzyme task-force for nucleus protection. PLoS One. 2010 Dec 10;5(12):e14125. DOI: 10.1371/journal.pone.0014125. PMID: 21170318; PMCID: PMC3000810.
El-Deiry W. S., Goldberg R. M., Lenz H. J. et al. The current state of molecular testing in the treatment of patients with solid tumors, 2019. CA Cancer J Clin. 2019 Jul;69(4):305—343. DOI: 10.3322/caac.21560.
Tsimberidou A. M., Fountzilas E., Bleris L., Kurzrock R. Transcriptomics and solid tumors: The next frontier in precision cancer medicine. Semin Cancer Biol. 2022 Sep;84:50-59. DOI: 10.1016/j.semcancer.2020.09.007.
Lu W., Zhou Q., Chen Y. Impact of RNA degradation on next-generation sequencing transcriptome data. Genomics. 2022 Jul;114(4):110429. DOI: 10.1016/j.ygeno.2022.110429.
ДНК — это многотомное собрание информации, содержащее данные о каждом признаке и особенности нашего организма. Обнаружить изменения в ДНК можно несколькими способами. Некоторые типичные и часто встречающиеся генетические нарушения известны врачам заранее. Например, саркома Юинга развивается, когда участок хромосомы 22 случайно сливается с участком хромосомы 11, что запускает неконтролируемое деление клеток2. Эта мутация хорошо изучена, и существуют стандартные диагностические наборы для её выявления.
Но представим ситуацию, что никакого слияния 11 и 22 хромосомы не обнаружено, все остальные стандартные тесты также не показали результата. Тогда врачам приходится проверять множество генов, связанных с заболеванием, чтобы обнаружить ошибку. Этот процесс, называемый полногеномным секвенированием, сложен и похож на поиск иголки в стоге сена.
Ситуация с лимфомами и геобластозами осложняется тем, что по сравнению с другими онкологическими заболеваниями, количество возможных изменений намного больше, из-за чего требуется применять дополнительные методы диагностики.
Молекулы ДНК хранятся в ядре клетки. Это своеобразный «сейф», стенки которого защищают наследственную информацию от ферментов и активных химических веществ, образующихся в результате жизнедеятельности клетки9. Построение белков, наоборот, происходит в активной зоне — цитозоле, где «кипят» химические реакции. Чтобы преодолеть эти барьеры, требуется посредник — матричная РНК (мРНК).
Молекула мРНК по химической структуре похожа на ДНК, она также состоит из последовательности нуклеотидов. Процесс ее образования можно описать как перенос информации о строении одного гена с большого носителя — ДНК — на мобильный носитель, который будет в дальнейшем использоваться для построения белка. После копирования мРНК не сразу отправляется для синтеза белка, она проходит стадию процессинга (созревания). В это время из нее удаляется ненужная для построения белка информация, добавляется «сопроводительная документация», помогающая мРНК выйти из ядра, формируется финальный «чертеж», по которому будет строиться белок8.
Какие данные можно получить при секвенировании РНК
Если мРНК повторяет гены ДНК, то встает вопрос, зачем исследовать маленькие копии, если можно сразу посмотреть весь первоисточник. Однако секвенирование РНК значительно расширяет понимание генетических нарушений, метод позволяет получить следующую информацию:
Выявить значимые изменения. В ДНК одной клетки одновременно могут существовать сотни мутаций, и теоретически все их мы можем найти, сделав полногеномное секвенирование. Но, оказывается, не вся информация с ДНК переносится на мРНК, из-за чего большинство этих мутаций никак не отразится на жизни клетки. Полученные таким образом данные никак не повлияют на дальнейшее лечение. Исследуя мРНК, мы, напротив, сразу анализируем только значимые изменения, которые скопировались с ДНК и в дальнейшем приведут к синтезу дефектного белка.
Обнаружить новые типы заболеваний. Благодаря тому, что секвенирование РНК выявляет значимые генетические изменения, его результаты помогают с большей точностью выявлять новые и редкие мутации9, 10.
Найти ошибки процессинга. Генетические механизмы заболеваний могут быть чрезвычайно сложными. Причина изменения структуры белка может заключаться не в мутации гена, а в нарушении созревания мРНК. Процессинг происходит уже после создания копии гена и включает в себя более 150 модификаций нити РНК, в результате которых создается финальная матрица для синтеза белка. Нарушение на любом этапе может приводить к появлению дефектной матрицы мРНК и в дальнейшем к изменению белка11.
К недостаткам секвенирования РНК можно отнести его сложность. Молекулы нестабильны и могут разрушаться во время анализа, что снижает точность результата12.
Комбинированное секвенирование ДНК и РНК при гемобластозах и саркомах
Гемобластозы и саркомы возникают из-за разнообразных мутаций, включая потерю, вставку и замену нуклеотидов в составе гена, хромосомные перестройки и т. д. Особенно сложны с точки зрения диагностики перестройки. При них участок в цепи ДНК переезжает на новое место рядом с нехарактерным для него геном и изменяет его функцию. При саркомах врачи выявили 44 гена, слияние которых важно для диагностики и дальнейшего лечения4.
Обнаружить мутации можно, секвенируя молекулу ДНК. Генетик расшифрует интересующие гены, сверит их строение с базами данных и сделает заключение о нарушениях. Но когда речь заходит о редких или новых мутациях, сделать это становится сложнее. Приходится анализировать большие участки ДНК, исследовать расположение миллиардов нуклеотидов, что требует сложных вычислений. Кроме того, не все изменения ДНК имеют клиническую значимость. Даже если произошла перестройка в ДНК, ее копия мРНК может оставаться без изменений. Поэтому при этих заболеваниях анализ РНК может помочь врачам провести более точную диагностику.
- При секвенировании мРНК необходимо анализировать не всю огромную молекулу ДНК, а только копии, которые были сняты с нее. Это облегчает выявление редких и новых мутаций.
- Метод помогает избежать ошибок диагностики, поскольку показывает только перестройки, которые привели к изменениям в молекуле мРНК4.
В целом исследование РНК дополняет анализ ДНК, что используют для поиска сложных и редких генетических нарушений и выбора наиболее подходящего метода лечения.
MC-RU-01342 февраль 2025
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
McAleer S. A history of cancer and its treatment: Presidential Address to the Ulster Medical Society. 7th October 2021. Ulster Med J. 2022 Sep;91(3):124—129.
Pei J., Zhao X., Patchefsky A. S. Clinical application of RNA sequencing in sarcoma diagnosis: An institutional experience. Medicine (Baltimore). 2019 Jun;98(25):e16031. DOI: 10.1097/MD.0000000000016031.
He J., Abdel-Wahab O., Nahas M. K. et al. Integrated genomic DNA/RNA profiling of hematologic malignancies in the clinical setting. Blood. 2016 Jun 16;127(24):3004—3014. DOI: 10.1182/blood-2015-08-664649.
Huang X., Li G., Li L. et al. Establishing an RNA fusions panel in soft tissue sarcoma with clinical validation. Sci Rep. 2023 Mar 16;13(1):4403. DOI: 10.1038/s41598-023-29511-1.
Popovich J. R., Kashyap S., Gasalberti D. P., Cassaro S. Sarcoma. 2023 Aug 14. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan—. PMID: 30137818.
Abdulmawjood B., Roma-Rodrigues C., Fernandes A. R, Baptista P. V. Liquid biopsies in myeloid malignancies. Cancer Drug Resist. 2019 Dec 19;2(4):1044—1061. DOI: 10.20517/cdr.2019.88.
Morgan M. D., Pairo-Castineira E., Rawlik K. et al. Genome-wide study of hair colour in UK Biobank explains most of the SNP heritability. Nat Commun. 2018 Dec 10;9(1):5271. DOI: 10.1038/s41467-018-07691-z.
Alberts B., Johnson A., Lewis J. et al. Molecular biology of the cell. 4th edn. February 2003 Annals of Botany. 91(3):401. DOI:10.1093/aob/mcg023.
Fabrini R., Bocedi A., Pallottini V. et al. Nuclear shield: a multi-enzyme task-force for nucleus protection. PLoS One. 2010 Dec 10;5(12):e14125. DOI: 10.1371/journal.pone.0014125. PMID: 21170318; PMCID: PMC3000810.
El-Deiry W. S., Goldberg R. M., Lenz H. J. et al. The current state of molecular testing in the treatment of patients with solid tumors, 2019. CA Cancer J Clin. 2019 Jul;69(4):305—343. DOI: 10.3322/caac.21560.
Tsimberidou A. M., Fountzilas E., Bleris L., Kurzrock R. Transcriptomics and solid tumors: The next frontier in precision cancer medicine. Semin Cancer Biol. 2022 Sep;84:50-59. DOI: 10.1016/j.semcancer.2020.09.007.
Lu W., Zhou Q., Chen Y. Impact of RNA degradation on next-generation sequencing transcriptome data. Genomics. 2022 Jul;114(4):110429. DOI: 10.1016/j.ygeno.2022.110429.
Если мРНК повторяет гены ДНК, то встает вопрос, зачем исследовать маленькие копии, если можно сразу посмотреть весь первоисточник. Однако секвенирование РНК значительно расширяет понимание генетических нарушений, метод позволяет получить следующую информацию:
Выявить значимые изменения. В ДНК одной клетки одновременно могут существовать сотни мутаций, и теоретически все их мы можем найти, сделав полногеномное секвенирование. Но, оказывается, не вся информация с ДНК переносится на мРНК, из-за чего большинство этих мутаций никак не отразится на жизни клетки. Полученные таким образом данные никак не повлияют на дальнейшее лечение. Исследуя мРНК, мы, напротив, сразу анализируем только значимые изменения, которые скопировались с ДНК и в дальнейшем приведут к синтезу дефектного белка.
Обнаружить новые типы заболеваний. Благодаря тому, что секвенирование РНК выявляет значимые генетические изменения, его результаты помогают с большей точностью выявлять новые и редкие мутации9, 10.
Найти ошибки процессинга. Генетические механизмы заболеваний могут быть чрезвычайно сложными. Причина изменения структуры белка может заключаться не в мутации гена, а в нарушении созревания мРНК. Процессинг происходит уже после создания копии гена и включает в себя более 150 модификаций нити РНК, в результате которых создается финальная матрица для синтеза белка. Нарушение на любом этапе может приводить к появлению дефектной матрицы мРНК и в дальнейшем к изменению белка11.
К недостаткам секвенирования РНК можно отнести его сложность. Молекулы нестабильны и могут разрушаться во время анализа, что снижает точность результата12.
Гемобластозы и саркомы возникают из-за разнообразных мутаций, включая потерю, вставку и замену нуклеотидов в составе гена, хромосомные перестройки и т. д. Особенно сложны с точки зрения диагностики перестройки. При них участок в цепи ДНК переезжает на новое место рядом с нехарактерным для него геном и изменяет его функцию. При саркомах врачи выявили 44 гена, слияние которых важно для диагностики и дальнейшего лечения4.
Обнаружить мутации можно, секвенируя молекулу ДНК. Генетик расшифрует интересующие гены, сверит их строение с базами данных и сделает заключение о нарушениях. Но когда речь заходит о редких или новых мутациях, сделать это становится сложнее. Приходится анализировать большие участки ДНК, исследовать расположение миллиардов нуклеотидов, что требует сложных вычислений. Кроме того, не все изменения ДНК имеют клиническую значимость. Даже если произошла перестройка в ДНК, ее копия мРНК может оставаться без изменений. Поэтому при этих заболеваниях анализ РНК может помочь врачам провести более точную диагностику.
- При секвенировании мРНК необходимо анализировать не всю огромную молекулу ДНК, а только копии, которые были сняты с нее. Это облегчает выявление редких и новых мутаций.
- Метод помогает избежать ошибок диагностики, поскольку показывает только перестройки, которые привели к изменениям в молекуле мРНК4.
В целом исследование РНК дополняет анализ ДНК, что используют для поиска сложных и редких генетических нарушений и выбора наиболее подходящего метода лечения.
MC-RU-01342 февраль 2025
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Список литературы
McAleer S. A history of cancer and its treatment: Presidential Address to the Ulster Medical Society. 7th October 2021. Ulster Med J. 2022 Sep;91(3):124—129.
Pei J., Zhao X., Patchefsky A. S. Clinical application of RNA sequencing in sarcoma diagnosis: An institutional experience. Medicine (Baltimore). 2019 Jun;98(25):e16031. DOI: 10.1097/MD.0000000000016031.
He J., Abdel-Wahab O., Nahas M. K. et al. Integrated genomic DNA/RNA profiling of hematologic malignancies in the clinical setting. Blood. 2016 Jun 16;127(24):3004—3014. DOI: 10.1182/blood-2015-08-664649.
Huang X., Li G., Li L. et al. Establishing an RNA fusions panel in soft tissue sarcoma with clinical validation. Sci Rep. 2023 Mar 16;13(1):4403. DOI: 10.1038/s41598-023-29511-1.
Popovich J. R., Kashyap S., Gasalberti D. P., Cassaro S. Sarcoma. 2023 Aug 14. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan—. PMID: 30137818.
Abdulmawjood B., Roma-Rodrigues C., Fernandes A. R, Baptista P. V. Liquid biopsies in myeloid malignancies. Cancer Drug Resist. 2019 Dec 19;2(4):1044—1061. DOI: 10.20517/cdr.2019.88.
Morgan M. D., Pairo-Castineira E., Rawlik K. et al. Genome-wide study of hair colour in UK Biobank explains most of the SNP heritability. Nat Commun. 2018 Dec 10;9(1):5271. DOI: 10.1038/s41467-018-07691-z.
Alberts B., Johnson A., Lewis J. et al. Molecular biology of the cell. 4th edn. February 2003 Annals of Botany. 91(3):401. DOI:10.1093/aob/mcg023.
Fabrini R., Bocedi A., Pallottini V. et al. Nuclear shield: a multi-enzyme task-force for nucleus protection. PLoS One. 2010 Dec 10;5(12):e14125. DOI: 10.1371/journal.pone.0014125. PMID: 21170318; PMCID: PMC3000810.
El-Deiry W. S., Goldberg R. M., Lenz H. J. et al. The current state of molecular testing in the treatment of patients with solid tumors, 2019. CA Cancer J Clin. 2019 Jul;69(4):305—343. DOI: 10.3322/caac.21560.
Tsimberidou A. M., Fountzilas E., Bleris L., Kurzrock R. Transcriptomics and solid tumors: The next frontier in precision cancer medicine. Semin Cancer Biol. 2022 Sep;84:50-59. DOI: 10.1016/j.semcancer.2020.09.007.
Lu W., Zhou Q., Chen Y. Impact of RNA degradation on next-generation sequencing transcriptome data. Genomics. 2022 Jul;114(4):110429. DOI: 10.1016/j.ygeno.2022.110429.