Говорим о том, как измерить мутационную нагрузку и как это влияет на эффективность иммунотерапии.
Зачем онкологи считают мутации: опухолевая мутационная нагрузка и выбор терапии
1
Содержание статьи
Когда иммунотерапия подходит для лечения рака Что такое опухолевая мутационная нагрузка Как работает противоопухолевый иммунитет Как понять, будет ли эффективна иммунотерапия Зачем определять опухолевую мутационную нагрузку
Когда иммунотерапия подходит для лечения рака
Долгое время в лечении онкологических заболеваний применяли три метода: опухоль удаляли хирургически, облучали и воздействовали на нее химиотерапией — веществами, которые уничтожают быстро делящиеся клетки. Эти методы сделали возможной борьбу с раком.
Однако, несмотря на старания врачей, через некоторое время заболевание могло возвращаться и прогрессировало. Новым прорывом стало применение иммунотерапии. Она повышает способность иммунитета бороться с опухолевыми клетками.
Иммунотерапия сделала многие смертельные заболевания излечимыми. Например, до 2011 года диагноз метастатической меланомы в большинстве случаев означал для человека смертельный исход.
С началом использования иммунотерапии 50% пациентов смогли достигнуть длительной ремиссии1.
Клинические исследования показывают, что пациенты с одним и тем же заболеванием могут по разному реагировать на это лечение. Чтобы понять, будет ли иммунотерапия работать в конкретном случае, врачи исследуют характеристики опухоли, которые могут предсказать ее ответ:
- микросателлитную нестабильность (MSI);
- уровень экспрессии лиганда программируемой клеточной смерти (PD-L1);
- опухолевую мутационную нагрузку2 (TMB).
В этой статье мы расскажем об уровне экспрессии лиганда программируемой клеточной смерти (PD-L1) и опухолевой мутационной нагрузке.
Что такое опухолевая мутационная нагрузка
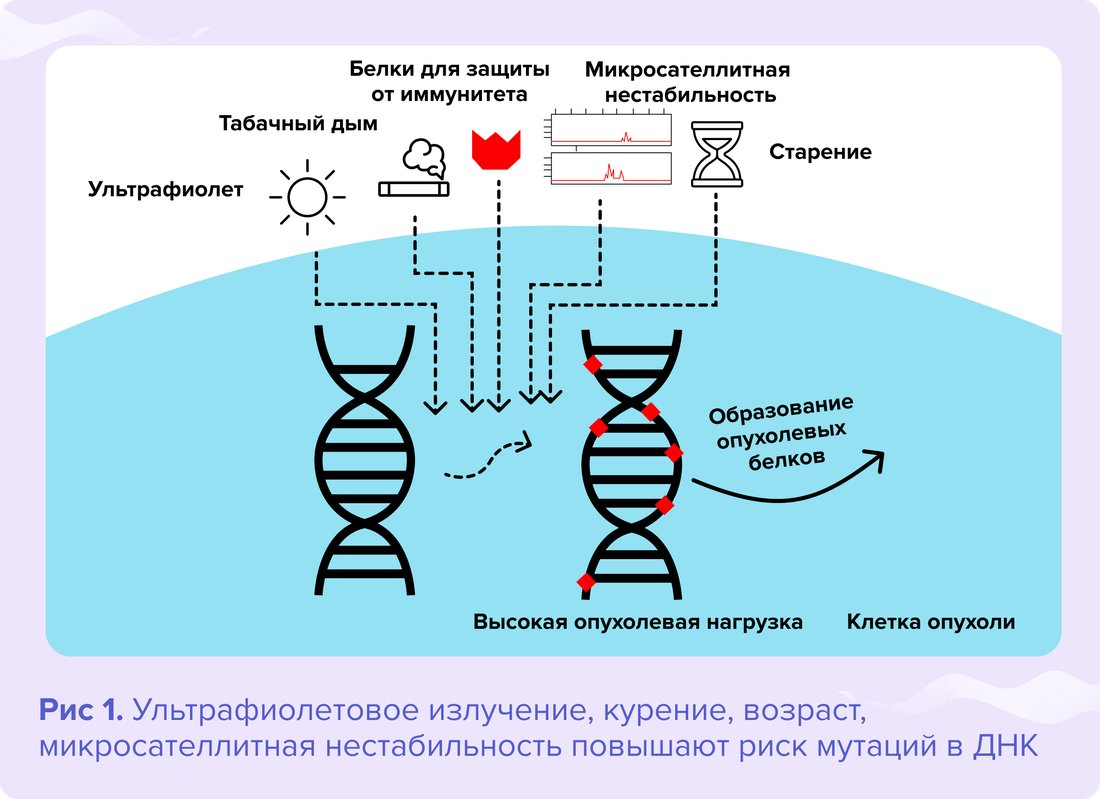
Причиной рака всегда являются мутации, которые привели к потере способности клетки регулировать рост и деление. Даже одной случайной мутации хватает, чтобы вызвать злокачественное перерождение. Но чаще раковая клетка содержит сразу несколько генетических изменений, которые повышают ее способность к делению, выживаемость, защищают от иммунной системы.
При разных опухолях число генетических изменений различается. Например, при раке, который возник в детском возрасте, в клетках в среднем обнаруживается 9,6 мутаций2. Причина повреждений при этом часто остается неизвестной, и высока вероятность того, что они произошли случайно.
Напротив, при меланоме и раке легкого клетки могут иметь более 200 различных мутаций2. Они возникают под воздействием канцерогенов, таких как солнечная радиация и табачный дым. Эти факторы повреждают ДНК и повышают риск развития онкологических заболеваний2.
Как работает противоопухолевый иммунитет
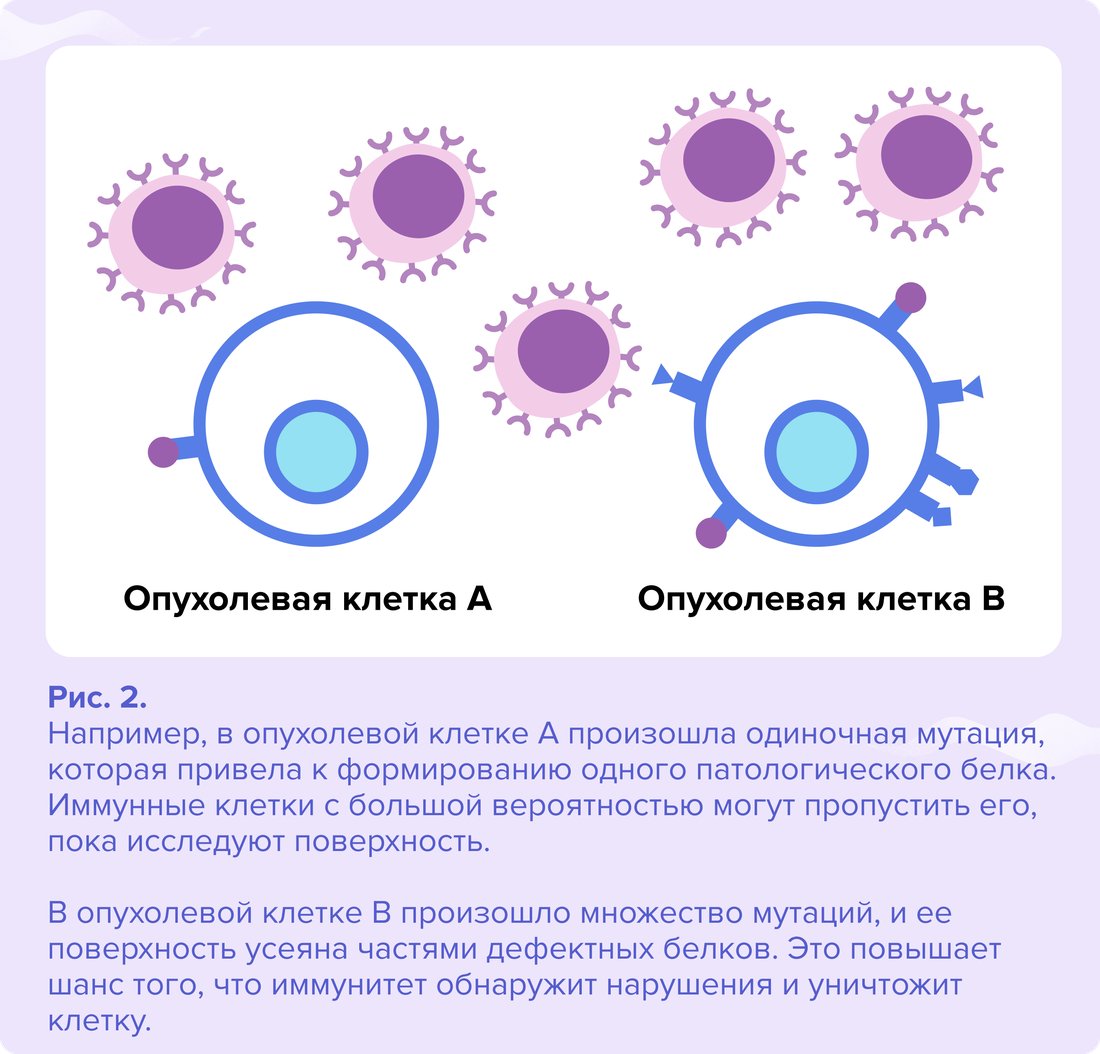
Все, что производит клетка, попадает на ее поверхность. Если происходит сбой — мутация, на поверхности оказываются дефектные продукты. Иммунная система обнаруживает это несоответствие и уничтожает клетку. Чем больше дефектных продуктов окажется на поверхности клетки, тем заметнее для иммунной системы она будет2. Поэтому опухоли, которые содержат большое количество мутаций, то есть имеют высокую мутационную нагрузку, должны вызывать сильный иммунный ответ.
Как понять, будет ли эффективна иммунотерапия
Чтобы выжить, опухолевая клетка приобретает механизмы, которые позволяют ей уходить из-под действия иммунитета. Один из них — выработка белка лиганда программируемой клеточной гибели (PD-L1). При взаимодействии с иммунной клеткой он снижает ее активность, из-за чего та не замечает беспорядка на клеточной поверхности. Иммунотерапия блокирует действие PD-L1, делает иммунные клетки вновь активными и помогает уничтожать опухоль.
Блокирование иммунной системы — один из способов выживания опухолевой клетки. Если он не является ведущим, то прием иммунотерапии не затормозит рост опухоли.
Чтобы понять, насколько будет эффективна иммунотерапия в каждом случае, врачи могут оценивать прогностические маркеры. Наиболее часто для этого врачи исследуют уровень PD-L1. Если его много на клетках опухоли, то с большой вероятностью иммунотерапия будет эффективной.
Второй важный показатель — мутационная нагрузка: чем больше мутаций произошло в опухоли, тем больше в ней образуется патологических белков, на которые реагирует иммунная система.
Другими словами, иммунная система более эффективно борется с опухолями, которые содержат большее число генетических нарушений. Поэтому активация иммунитета с помощью иммунотерапии более эффективна при высокой опухолевой мутационной нагрузке.
Зачем определять опухолевую мутационную нагрузку
Наша ДНК представляет собой длинную цепочку из «бусин» четырех видов нуклеотидов. Каждый из них содержит по одному азотистому основанию: аденин (А), тимин (Т), гуанин (Г) или цитозин (Ц). Их последовательность постоянна, а задача клетки — сохранить ее в неизменном виде3. Таких звеньев в нашей ДНК около 3 млрд4. Потеря части цепочки, лишние «бусины» или нарушение их порядка называются мутациями.
Чтобы определить опухолевую мутационную нагрузку, нужно знать, сколько всего мутаций содержится в опухолевой клетке. Для этого среди прочих применяют метод секвенирования нового поколения (NGS). Он позволяет одновременно оценить множество генов, связанных с онкологическими заболеваниями.
Для анализа используют образец опухолевой ткани, полученный во время биопсии. Обычно он хранится в медицинской документации в виде парафинового блока. Если биопсию провести невозможно или недостаточно материала, то можно использовать кровь из вены. Такой метод исследования называется жидкостной биопсией.
Исследования показывают связь между мутационной нагрузкой и эффективностью иммунотерапии при меланоме, раке легкого, уротелиальном раке и других опухолях. Людям с высокой мутационной нагрузкой чаще помогает иммунотерапия, и они имеют более низкий риск прогрессирования заболевания5.
Врач может назначить исследование опухолевой мутационной нагрузки в сложных случаях, когда нет уверенности, что иммунотерапия будет эффективна. Такая ситуация возможна при первично множественном раке, когда заболевание возникает сразу или поочередно в нескольких частях тела6. Часто такое бывает при наследственных типах рака.
Мутационная нагрузка пока не является обязательным видом диагностики. Идут исследования, в которых изучают ее пользу при различных видах рака. Однако врач может назначить ее измерение в нестандартных случаях, когда встает вопрос о назначении иммунотерапии.
MC-RU-01342 февраль 2025
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
McAleer S. A history of cancer and its treatment: Presidential Address to the Ulster Medical Society. 7th October 2021. Ulster Med J. 2022 Sep;91(3):124–129.
Doig K. D., Fellowes A., Scott P., Fox S. B. Tumour mutational burden: an overview for pathologists. Pathology. 2022 Apr;54(3):249–253. DOI: 10.1016/j.pathol.2021.11.008.
Alberts B, Johnson A, Lewis J, et al. Molecular biology of the cell. New York: Garland Science, 2002. A Note to the Reader. (Электронный ресурс). URL: https://www.ncbi.nlm.nih.gov/books/NBK21060/ (дата обращения: 05.12.2024).
Toledo C., Saltsman K. Genetics by the Numbers. National Institute of General Medical Sciences. (Электронный ресурс). URL: https://publications.nigms.nih.gov/insidelifescience/geneticsnumbers (дата обращения: 05.12.2024).
Sha D., Jin Z., Budczies J. et al. Tumor mutational burden as a predictive biomarker in solid tumors. Cancer Discov. 2020 Dec;10(12):1808–1825. DOI: 10.1158/2159-8290.CD-20-0522.
Vogt A., Schmid S., Heinimann K. et al. Multiple primary tumours: challenges and approaches, a review. ESMO Open. 2017 May 2;2(2):e000172. DOI: 10.1136/esmoopen-2017-000172.
Долгое время в лечении онкологических заболеваний применяли три метода: опухоль удаляли хирургически, облучали и воздействовали на нее химиотерапией — веществами, которые уничтожают быстро делящиеся клетки. Эти методы сделали возможной борьбу с раком.
Однако, несмотря на старания врачей, через некоторое время заболевание могло возвращаться и прогрессировало. Новым прорывом стало применение иммунотерапии. Она повышает способность иммунитета бороться с опухолевыми клетками.
Иммунотерапия сделала многие смертельные заболевания излечимыми. Например, до 2011 года диагноз метастатической меланомы в большинстве случаев означал для человека смертельный исход.
С началом использования иммунотерапии 50% пациентов смогли достигнуть длительной ремиссии1.
Клинические исследования показывают, что пациенты с одним и тем же заболеванием могут по разному реагировать на это лечение. Чтобы понять, будет ли иммунотерапия работать в конкретном случае, врачи исследуют характеристики опухоли, которые могут предсказать ее ответ:
- микросателлитную нестабильность (MSI);
- уровень экспрессии лиганда программируемой клеточной смерти (PD-L1);
- опухолевую мутационную нагрузку2 (TMB).
В этой статье мы расскажем об уровне экспрессии лиганда программируемой клеточной смерти (PD-L1) и опухолевой мутационной нагрузке.
Причиной рака всегда являются мутации, которые привели к потере способности клетки регулировать рост и деление. Даже одной случайной мутации хватает, чтобы вызвать злокачественное перерождение. Но чаще раковая клетка содержит сразу несколько генетических изменений, которые повышают ее способность к делению, выживаемость, защищают от иммунной системы.
При разных опухолях число генетических изменений различается. Например, при раке, который возник в детском возрасте, в клетках в среднем обнаруживается 9,6 мутаций2. Причина повреждений при этом часто остается неизвестной, и высока вероятность того, что они произошли случайно.
Напротив, при меланоме и раке легкого клетки могут иметь более 200 различных мутаций2. Они возникают под воздействием канцерогенов, таких как солнечная радиация и табачный дым. Эти факторы повреждают ДНК и повышают риск развития онкологических заболеваний2.
Как работает противоопухолевый иммунитет
Все, что производит клетка, попадает на ее поверхность. Если происходит сбой — мутация, на поверхности оказываются дефектные продукты. Иммунная система обнаруживает это несоответствие и уничтожает клетку. Чем больше дефектных продуктов окажется на поверхности клетки, тем заметнее для иммунной системы она будет2. Поэтому опухоли, которые содержат большое количество мутаций, то есть имеют высокую мутационную нагрузку, должны вызывать сильный иммунный ответ.
Как понять, будет ли эффективна иммунотерапия
Чтобы выжить, опухолевая клетка приобретает механизмы, которые позволяют ей уходить из-под действия иммунитета. Один из них — выработка белка лиганда программируемой клеточной гибели (PD-L1). При взаимодействии с иммунной клеткой он снижает ее активность, из-за чего та не замечает беспорядка на клеточной поверхности. Иммунотерапия блокирует действие PD-L1, делает иммунные клетки вновь активными и помогает уничтожать опухоль.
Блокирование иммунной системы — один из способов выживания опухолевой клетки. Если он не является ведущим, то прием иммунотерапии не затормозит рост опухоли.
Чтобы понять, насколько будет эффективна иммунотерапия в каждом случае, врачи могут оценивать прогностические маркеры. Наиболее часто для этого врачи исследуют уровень PD-L1. Если его много на клетках опухоли, то с большой вероятностью иммунотерапия будет эффективной.
Второй важный показатель — мутационная нагрузка: чем больше мутаций произошло в опухоли, тем больше в ней образуется патологических белков, на которые реагирует иммунная система.
Другими словами, иммунная система более эффективно борется с опухолями, которые содержат большее число генетических нарушений. Поэтому активация иммунитета с помощью иммунотерапии более эффективна при высокой опухолевой мутационной нагрузке.
Зачем определять опухолевую мутационную нагрузку
Наша ДНК представляет собой длинную цепочку из «бусин» четырех видов нуклеотидов. Каждый из них содержит по одному азотистому основанию: аденин (А), тимин (Т), гуанин (Г) или цитозин (Ц). Их последовательность постоянна, а задача клетки — сохранить ее в неизменном виде3. Таких звеньев в нашей ДНК около 3 млрд4. Потеря части цепочки, лишние «бусины» или нарушение их порядка называются мутациями.
Чтобы определить опухолевую мутационную нагрузку, нужно знать, сколько всего мутаций содержится в опухолевой клетке. Для этого среди прочих применяют метод секвенирования нового поколения (NGS). Он позволяет одновременно оценить множество генов, связанных с онкологическими заболеваниями.
Для анализа используют образец опухолевой ткани, полученный во время биопсии. Обычно он хранится в медицинской документации в виде парафинового блока. Если биопсию провести невозможно или недостаточно материала, то можно использовать кровь из вены. Такой метод исследования называется жидкостной биопсией.
Исследования показывают связь между мутационной нагрузкой и эффективностью иммунотерапии при меланоме, раке легкого, уротелиальном раке и других опухолях. Людям с высокой мутационной нагрузкой чаще помогает иммунотерапия, и они имеют более низкий риск прогрессирования заболевания5.
Врач может назначить исследование опухолевой мутационной нагрузки в сложных случаях, когда нет уверенности, что иммунотерапия будет эффективна. Такая ситуация возможна при первично множественном раке, когда заболевание возникает сразу или поочередно в нескольких частях тела6. Часто такое бывает при наследственных типах рака.
Мутационная нагрузка пока не является обязательным видом диагностики. Идут исследования, в которых изучают ее пользу при различных видах рака. Однако врач может назначить ее измерение в нестандартных случаях, когда встает вопрос о назначении иммунотерапии.
MC-RU-01342 февраль 2025
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
McAleer S. A history of cancer and its treatment: Presidential Address to the Ulster Medical Society. 7th October 2021. Ulster Med J. 2022 Sep;91(3):124–129.
Doig K. D., Fellowes A., Scott P., Fox S. B. Tumour mutational burden: an overview for pathologists. Pathology. 2022 Apr;54(3):249–253. DOI: 10.1016/j.pathol.2021.11.008.
Alberts B, Johnson A, Lewis J, et al. Molecular biology of the cell. New York: Garland Science, 2002. A Note to the Reader. (Электронный ресурс). URL: https://www.ncbi.nlm.nih.gov/books/NBK21060/ (дата обращения: 05.12.2024).
Toledo C., Saltsman K. Genetics by the Numbers. National Institute of General Medical Sciences. (Электронный ресурс). URL: https://publications.nigms.nih.gov/insidelifescience/geneticsnumbers (дата обращения: 05.12.2024).
Sha D., Jin Z., Budczies J. et al. Tumor mutational burden as a predictive biomarker in solid tumors. Cancer Discov. 2020 Dec;10(12):1808–1825. DOI: 10.1158/2159-8290.CD-20-0522.
Vogt A., Schmid S., Heinimann K. et al. Multiple primary tumours: challenges and approaches, a review. ESMO Open. 2017 May 2;2(2):e000172. DOI: 10.1136/esmoopen-2017-000172.
Все, что производит клетка, попадает на ее поверхность. Если происходит сбой — мутация, на поверхности оказываются дефектные продукты. Иммунная система обнаруживает это несоответствие и уничтожает клетку. Чем больше дефектных продуктов окажется на поверхности клетки, тем заметнее для иммунной системы она будет2. Поэтому опухоли, которые содержат большое количество мутаций, то есть имеют высокую мутационную нагрузку, должны вызывать сильный иммунный ответ.
Чтобы выжить, опухолевая клетка приобретает механизмы, которые позволяют ей уходить из-под действия иммунитета. Один из них — выработка белка лиганда программируемой клеточной гибели (PD-L1). При взаимодействии с иммунной клеткой он снижает ее активность, из-за чего та не замечает беспорядка на клеточной поверхности. Иммунотерапия блокирует действие PD-L1, делает иммунные клетки вновь активными и помогает уничтожать опухоль.
Блокирование иммунной системы — один из способов выживания опухолевой клетки. Если он не является ведущим, то прием иммунотерапии не затормозит рост опухоли.
Чтобы понять, насколько будет эффективна иммунотерапия в каждом случае, врачи могут оценивать прогностические маркеры. Наиболее часто для этого врачи исследуют уровень PD-L1. Если его много на клетках опухоли, то с большой вероятностью иммунотерапия будет эффективной.
Второй важный показатель — мутационная нагрузка: чем больше мутаций произошло в опухоли, тем больше в ней образуется патологических белков, на которые реагирует иммунная система.
Другими словами, иммунная система более эффективно борется с опухолями, которые содержат большее число генетических нарушений. Поэтому активация иммунитета с помощью иммунотерапии более эффективна при высокой опухолевой мутационной нагрузке.
Зачем определять опухолевую мутационную нагрузку
Наша ДНК представляет собой длинную цепочку из «бусин» четырех видов нуклеотидов. Каждый из них содержит по одному азотистому основанию: аденин (А), тимин (Т), гуанин (Г) или цитозин (Ц). Их последовательность постоянна, а задача клетки — сохранить ее в неизменном виде3. Таких звеньев в нашей ДНК около 3 млрд4. Потеря части цепочки, лишние «бусины» или нарушение их порядка называются мутациями.
Чтобы определить опухолевую мутационную нагрузку, нужно знать, сколько всего мутаций содержится в опухолевой клетке. Для этого среди прочих применяют метод секвенирования нового поколения (NGS). Он позволяет одновременно оценить множество генов, связанных с онкологическими заболеваниями.
Для анализа используют образец опухолевой ткани, полученный во время биопсии. Обычно он хранится в медицинской документации в виде парафинового блока. Если биопсию провести невозможно или недостаточно материала, то можно использовать кровь из вены. Такой метод исследования называется жидкостной биопсией.
Исследования показывают связь между мутационной нагрузкой и эффективностью иммунотерапии при меланоме, раке легкого, уротелиальном раке и других опухолях. Людям с высокой мутационной нагрузкой чаще помогает иммунотерапия, и они имеют более низкий риск прогрессирования заболевания5.
Врач может назначить исследование опухолевой мутационной нагрузки в сложных случаях, когда нет уверенности, что иммунотерапия будет эффективна. Такая ситуация возможна при первично множественном раке, когда заболевание возникает сразу или поочередно в нескольких частях тела6. Часто такое бывает при наследственных типах рака.
Мутационная нагрузка пока не является обязательным видом диагностики. Идут исследования, в которых изучают ее пользу при различных видах рака. Однако врач может назначить ее измерение в нестандартных случаях, когда встает вопрос о назначении иммунотерапии.
MC-RU-01342 февраль 2025
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
McAleer S. A history of cancer and its treatment: Presidential Address to the Ulster Medical Society. 7th October 2021. Ulster Med J. 2022 Sep;91(3):124–129.
Doig K. D., Fellowes A., Scott P., Fox S. B. Tumour mutational burden: an overview for pathologists. Pathology. 2022 Apr;54(3):249–253. DOI: 10.1016/j.pathol.2021.11.008.
Alberts B, Johnson A, Lewis J, et al. Molecular biology of the cell. New York: Garland Science, 2002. A Note to the Reader. (Электронный ресурс). URL: https://www.ncbi.nlm.nih.gov/books/NBK21060/ (дата обращения: 05.12.2024).
Toledo C., Saltsman K. Genetics by the Numbers. National Institute of General Medical Sciences. (Электронный ресурс). URL: https://publications.nigms.nih.gov/insidelifescience/geneticsnumbers (дата обращения: 05.12.2024).
Sha D., Jin Z., Budczies J. et al. Tumor mutational burden as a predictive biomarker in solid tumors. Cancer Discov. 2020 Dec;10(12):1808–1825. DOI: 10.1158/2159-8290.CD-20-0522.
Vogt A., Schmid S., Heinimann K. et al. Multiple primary tumours: challenges and approaches, a review. ESMO Open. 2017 May 2;2(2):e000172. DOI: 10.1136/esmoopen-2017-000172.
Наша ДНК представляет собой длинную цепочку из «бусин» четырех видов нуклеотидов. Каждый из них содержит по одному азотистому основанию: аденин (А), тимин (Т), гуанин (Г) или цитозин (Ц). Их последовательность постоянна, а задача клетки — сохранить ее в неизменном виде3. Таких звеньев в нашей ДНК около 3 млрд4. Потеря части цепочки, лишние «бусины» или нарушение их порядка называются мутациями.
Чтобы определить опухолевую мутационную нагрузку, нужно знать, сколько всего мутаций содержится в опухолевой клетке. Для этого среди прочих применяют метод секвенирования нового поколения (NGS). Он позволяет одновременно оценить множество генов, связанных с онкологическими заболеваниями.
Для анализа используют образец опухолевой ткани, полученный во время биопсии. Обычно он хранится в медицинской документации в виде парафинового блока. Если биопсию провести невозможно или недостаточно материала, то можно использовать кровь из вены. Такой метод исследования называется жидкостной биопсией.
Исследования показывают связь между мутационной нагрузкой и эффективностью иммунотерапии при меланоме, раке легкого, уротелиальном раке и других опухолях. Людям с высокой мутационной нагрузкой чаще помогает иммунотерапия, и они имеют более низкий риск прогрессирования заболевания5.
Врач может назначить исследование опухолевой мутационной нагрузки в сложных случаях, когда нет уверенности, что иммунотерапия будет эффективна. Такая ситуация возможна при первично множественном раке, когда заболевание возникает сразу или поочередно в нескольких частях тела6. Часто такое бывает при наследственных типах рака.
Мутационная нагрузка пока не является обязательным видом диагностики. Идут исследования, в которых изучают ее пользу при различных видах рака. Однако врач может назначить ее измерение в нестандартных случаях, когда встает вопрос о назначении иммунотерапии.
MC-RU-01342 февраль 2025
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Список литературы
McAleer S. A history of cancer and its treatment: Presidential Address to the Ulster Medical Society. 7th October 2021. Ulster Med J. 2022 Sep;91(3):124–129.
Doig K. D., Fellowes A., Scott P., Fox S. B. Tumour mutational burden: an overview for pathologists. Pathology. 2022 Apr;54(3):249–253. DOI: 10.1016/j.pathol.2021.11.008.
Alberts B, Johnson A, Lewis J, et al. Molecular biology of the cell. New York: Garland Science, 2002. A Note to the Reader. (Электронный ресурс). URL: https://www.ncbi.nlm.nih.gov/books/NBK21060/ (дата обращения: 05.12.2024).
Toledo C., Saltsman K. Genetics by the Numbers. National Institute of General Medical Sciences. (Электронный ресурс). URL: https://publications.nigms.nih.gov/insidelifescience/geneticsnumbers (дата обращения: 05.12.2024).
Sha D., Jin Z., Budczies J. et al. Tumor mutational burden as a predictive biomarker in solid tumors. Cancer Discov. 2020 Dec;10(12):1808–1825. DOI: 10.1158/2159-8290.CD-20-0522.
Vogt A., Schmid S., Heinimann K. et al. Multiple primary tumours: challenges and approaches, a review. ESMO Open. 2017 May 2;2(2):e000172. DOI: 10.1136/esmoopen-2017-000172.