Иммунотерапия — один из новых способов лечения рака
2
Содержание статьи
Как рак ускользает от иммунной системы Направления иммунотерапии Возможности терапии Перспективные направления иммунотерапии
В последние несколько десятилетий терапия онкологических заболеваний развивается все более стремительно, разрабатываются новые подходы к лечению. Наряду с химиотерапией и таргетными препаратами важную позицию занимает иммунотерапия, которая в 2013 году стала, по мнению редакции журнала Science, прорывом года¹.
Идея о том, что иммунную систему можно научить бороться с раком, как это делают вакцины с инфекционными агентами, родилась еще в конце XVIII века. Тогда ученые вводили себе раковые клетки, чтобы предотвратить развитие злокачественных новообразований или вылечить уже имеющееся заболевание². Конечно, эти попытки не увенчались успехом. Долгое время активация иммунной системы для борьбы с раком не представлялась возможной. В 1909 году Пауль Эрлих предположил, что образование опухолевых клеток — процесс, который постоянно происходит в организме человека, но иммунная система сдерживает его². Гипотезу удалось подтвердить только в 1950-х годах, когда была выдвинута теория иммунного надзора, согласно которой Т-клетки постоянно мониторят патологические образования и уничтожают их. Однако, в процессе проверки этой версии обнаружился ряд несоответствий. Вопросов было больше, чем ответов.
Как рак ускользает от иммунной системы
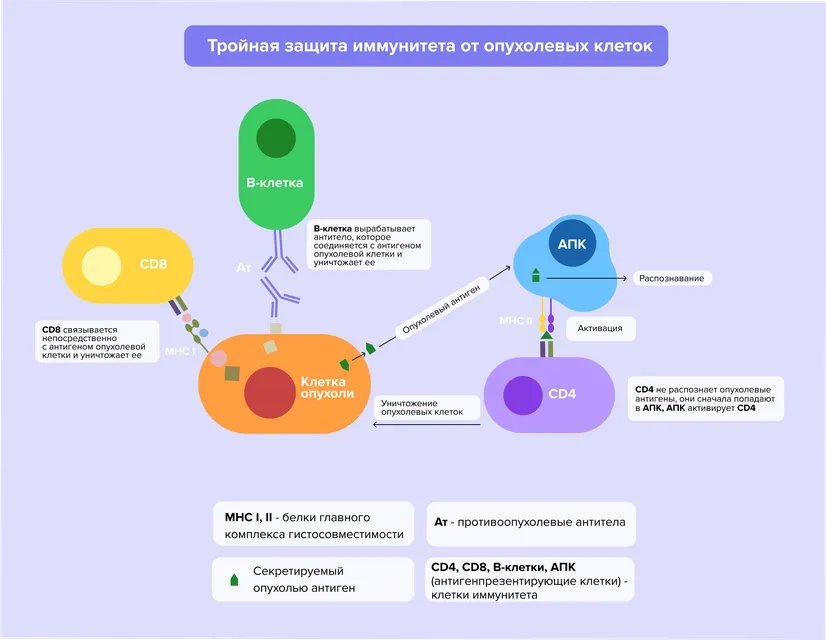
Иммунная система человека знает о том, какие белки в какой клетке содержатся. На поверхности клеток находится главный комплекс гистосовместимости (MHC), включающий небольшие фрагменты белков, присутствующих в них. Когда охранники иммунитета — Т-киллеры — проводят мониторинг таких комплексов, они могут распознать патологические процессы и уничтожить опухолевые клетки. Но даже при столь совершенной модели безопасности мутировавшие ткани умеют скрываться от иммунной системы. Во-первых, раковые клетки могут перестать вырабатывать один или несколько типов молекул главного комплекса гистосовместимости, необходимых для их распознавания³. Во-вторых, опухолевые клетки способны продуцировать различные иммуносупрессорные факторы и вещества, подавляющие иммунный ответ организма: трансформирующий фактор роста бета (TGF-бета), интерлейкин-10 (IL-10), фактор роста сосудистого эндотелия (VEGF) и др. И, наконец, такие клетки обладают более высокой устойчивостью к апоптозу — их запрограммированной гибели, которая наступает (или, по крайней мере, должна наступать) из-за накопления «поломок»³.
Понять, как все-таки работают эти механизмы, впервые смогли Джеймс П. Эллисон и Тасуку Хондзё. Они изучали клеточный рецептор PD-1 и связанный с ним лиганд (химическое соединение, которое связывается с той или иной биомолекулой, в результате чего возникает определенный биологический эффект) PD-L1. В 2002 году ученые обнаружили, что опухолевые клетки способны производить большое количество такого лиганда. Это позволяет им защищаться от уничтожения. В 2018 году Эллисон и Хондзё получили Нобелевскую премию в области физиологии и медицины за открытие нового подхода к терапии рака. Ингибиторы PD-1 и PD-L1 предотвращают связывание лигандов PD-L1 с рецепторами и позволяют иммунной системе обнаружить опухолевые клетки.
Направления иммунотерапии
Активная неспецифическая терапия основана на стимуляции неспецифического противоопухолевого иммунного ответа с применением антигенных препаратов: цитокинов, бактериальных продуктов, синтетических молекул или гормонов. К примеру, цитокины IFN-α и IL-23 уже успешно применяются в клинической практике для лечения пациентов с лейкемией и меланомой.
Активная специфическая иммунотерапия проводится с помощью вакцин. В настоящее время ведется разработка как профилактических прививок, нацеленных на предотвращение риска заболевания или его рецидива, так и терапевтических, созданных для лечения. На данный момент в клинической практике используются профилактические вакцины против папилломавирусной инфекции и вирусного гепатита B. Кроме того, терапевтическая вакцина на основе дендритных клеток одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для терапии пациентов с метастатическим раком простаты³.
Пассивная неспецифическая иммунотерапия основана на активации эффекторных клеток вне организма и последующем введении их в организм. В настоящее время ученые изучают возможности применения такой терапии у пациентов с меланомой, метастатической карциномой почки и аденокарциномой поджелудочной железы³.
Пассивная специфическая иммунотерапия — вид таргетной терапии, который основан на введении в организм опухолеспецифичных антител, активированных с помощью опухолевых антигенов³.
Возможности терапии
Совсем недавно американские онкологи описали первый случай ремиссии пациентки с метастатическим раком молочной железы, устойчивым к другим методам лечения. Джуди Перкинс в 49 лет диагностировали гормонозависимый рак молочной железы с метастазами в печень и другие органы. По словам женщины, врачи предполагали, что она сможет прожить не более трех лет. Однако Джуди стала участницей клинических испытаний персонализированной Т-клеточной иммунотерапии. Ей провели биопсию опухоли для поиска специфичных мутаций, а также выделили из образцов ткани инфильтрирующие опухоль лимфоциты (TILs, tumor-infiltrating lymphocytes), чтобы найти среди них неоантиген-специфические клетки.
В результате исследования специалисты обнаружили 62 специфические мутации, выделили соответствующие пептиды, «показали» их лимфоцитам пациентки при помощи антиген-презентирующих клеток, а затем отобрали только те лимфоциты, которые реагировали на представленные им пептиды. Их размножили и ввели обратно пациентке параллельно с лечением иммунотерапевтическим препаратом. Через 42 недели врачи отметили полный клинический ответ на терапию. К моменту публикации этого исследования в журнале Nature ремиссия длилась почти два года⁴.
Иммунотерапия используется в лечении множества видов онкологических заболеваний. Однако, лучшие результаты пока получены у пациентов с раком легкого и меланомой. Злокачественная опухоль развивается у каждого пациента совершенно по-своему, поэтому лечение требуется подбирать с учетом индивидуальных особенностей.
Перспективные направления иммунотерапии
Как и многие открытия в науке, это было сделано почти случайно. Ученые Кардиффского университета в Великобритании искали не лекарство от рака, а Т-клетки, способные бороться с бактериями. Сами по себе Т-клетки не могут нацеливаться на бактерии или вирусы напрямую, поэтому проверяют другие клетки организма, находя те, что заражены патогеном. Для этого на поверхности Т-клеток существуют специальные рецепторы, специфичные для каждого из болезнетворных агентов.
Задачей ученых было найти Т-лимфоциты, которые могли бы распознавать и уничтожать сразу несколько типов бактерий. Они взяли множество таких клеток и проверили их на эту способность. В ходе исследования было установлено, что рецептор Т-клеток (TCR) распознает и позволяет уничтожить раковые клетки большинства типов опухолей у человека. Эти данные открывают новые возможности для иммунотерапии различных видов онкологических заболеваний⁵.
Стоит отметить, что такие возможности иммунной системы уже используют в одном из видов лечения. CAR-T-терапия как раз основана на умении Т-клеток обнаруживать опухоль. Но эта способность специфична и не может быть использована для всех пациентов без разбора: типов и даже подтипов рака очень много, поэтому сложно создать адекватные мишени. Удивительным оказалось другое: ученые обнаружили Т-лимфоцитарный пул, уничтоживший вообще все опухолевые клетки, независимо от их типа, не затронув здоровые. Затем исследователи один за другим удаляли из клеток различные белки, что позволило узнать, какой именно отвечает за этот процесс. Так был обнаружен протеин MR1⁵.
Белок MR1 находится в любой клетке нашего организма, и она необязательно должна быть опухолевой. Идея ученых в том, что можно использовать обнаруженный механизм распознавания вместо того, чтобы адаптировать Т-клетки к определенному виду рака, как при CAR-T-терапии. Исследователи пока не знают, каким образом происходит передача сигнала, и испытания прошли только на мышах. Однако, даже если в итоге работа не приведет к открытию заветного лекарства от рака, она может помочь найти новые средства его лечения и расширить понимание механизмов возникновения и развития заболевания.
M-RU-00008421 Ноябрь 2022
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Coontz R. Science's Top 10 Breakthroughs of 2013. (Электронный ресурс). sciencemag.org/news/2013/12/sciences-top-10-breakthroughs-2013-0 (дата обращения: 02.09.2020).
Ichim C.V. Revisiting immunosurveillance and immunostimulation: Implications for cancer immunotherapy. J Transl Med. 2005;3:8. DOI: 10.1186/1479-5876-3-8.
Южакова Д.В., Ширманова М.В., Сергеева Т.Ф. и др. Иммунотерапия злокачественных новообразований (обзор). Современные технологии в медицине. 2016;1:173–182.
Zacharakis N., Chinnasamy H., Black M. et al. Immune recognition of somatic mutations leading to complete durable regression in metastatic breast cancer. Nat Med. 2018;24(6):724–730. DOI: 10.1038/s41591-018-0040-8.
Crowther M.D., Dolton G., Legut M. et al. Genome-wide CRISPR–Cas9 screening reveals ubiquitous T cell cancer targeting via the monomorphic MHC class I-related protein MR1. Nat Immunol. 2020;21:178–185. DOI: 10.1038/s41590-019-0578-8.
Иммунная система человека знает о том, какие белки в какой клетке содержатся. На поверхности клеток находится главный комплекс гистосовместимости (MHC), включающий небольшие фрагменты белков, присутствующих в них. Когда охранники иммунитета — Т-киллеры — проводят мониторинг таких комплексов, они могут распознать патологические процессы и уничтожить опухолевые клетки. Но даже при столь совершенной модели безопасности мутировавшие ткани умеют скрываться от иммунной системы. Во-первых, раковые клетки могут перестать вырабатывать один или несколько типов молекул главного комплекса гистосовместимости, необходимых для их распознавания³. Во-вторых, опухолевые клетки способны продуцировать различные иммуносупрессорные факторы и вещества, подавляющие иммунный ответ организма: трансформирующий фактор роста бета (TGF-бета), интерлейкин-10 (IL-10), фактор роста сосудистого эндотелия (VEGF) и др. И, наконец, такие клетки обладают более высокой устойчивостью к апоптозу — их запрограммированной гибели, которая наступает (или, по крайней мере, должна наступать) из-за накопления «поломок»³.
Понять, как все-таки работают эти механизмы, впервые смогли Джеймс П. Эллисон и Тасуку Хондзё. Они изучали клеточный рецептор PD-1 и связанный с ним лиганд (химическое соединение, которое связывается с той или иной биомолекулой, в результате чего возникает определенный биологический эффект) PD-L1. В 2002 году ученые обнаружили, что опухолевые клетки способны производить большое количество такого лиганда. Это позволяет им защищаться от уничтожения. В 2018 году Эллисон и Хондзё получили Нобелевскую премию в области физиологии и медицины за открытие нового подхода к терапии рака. Ингибиторы PD-1 и PD-L1 предотвращают связывание лигандов PD-L1 с рецепторами и позволяют иммунной системе обнаружить опухолевые клетки.
Активная неспецифическая терапия основана на стимуляции неспецифического противоопухолевого иммунного ответа с применением антигенных препаратов: цитокинов, бактериальных продуктов, синтетических молекул или гормонов. К примеру, цитокины IFN-α и IL-23 уже успешно применяются в клинической практике для лечения пациентов с лейкемией и меланомой.
Активная специфическая иммунотерапия проводится с помощью вакцин. В настоящее время ведется разработка как профилактических прививок, нацеленных на предотвращение риска заболевания или его рецидива, так и терапевтических, созданных для лечения. На данный момент в клинической практике используются профилактические вакцины против папилломавирусной инфекции и вирусного гепатита B. Кроме того, терапевтическая вакцина на основе дендритных клеток одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для терапии пациентов с метастатическим раком простаты³.
Пассивная неспецифическая иммунотерапия основана на активации эффекторных клеток вне организма и последующем введении их в организм. В настоящее время ученые изучают возможности применения такой терапии у пациентов с меланомой, метастатической карциномой почки и аденокарциномой поджелудочной железы³.
Пассивная специфическая иммунотерапия — вид таргетной терапии, который основан на введении в организм опухолеспецифичных антител, активированных с помощью опухолевых антигенов³.
Возможности терапии
Совсем недавно американские онкологи описали первый случай ремиссии пациентки с метастатическим раком молочной железы, устойчивым к другим методам лечения. Джуди Перкинс в 49 лет диагностировали гормонозависимый рак молочной железы с метастазами в печень и другие органы. По словам женщины, врачи предполагали, что она сможет прожить не более трех лет. Однако Джуди стала участницей клинических испытаний персонализированной Т-клеточной иммунотерапии. Ей провели биопсию опухоли для поиска специфичных мутаций, а также выделили из образцов ткани инфильтрирующие опухоль лимфоциты (TILs, tumor-infiltrating lymphocytes), чтобы найти среди них неоантиген-специфические клетки.
В результате исследования специалисты обнаружили 62 специфические мутации, выделили соответствующие пептиды, «показали» их лимфоцитам пациентки при помощи антиген-презентирующих клеток, а затем отобрали только те лимфоциты, которые реагировали на представленные им пептиды. Их размножили и ввели обратно пациентке параллельно с лечением иммунотерапевтическим препаратом. Через 42 недели врачи отметили полный клинический ответ на терапию. К моменту публикации этого исследования в журнале Nature ремиссия длилась почти два года⁴.
Иммунотерапия используется в лечении множества видов онкологических заболеваний. Однако, лучшие результаты пока получены у пациентов с раком легкого и меланомой. Злокачественная опухоль развивается у каждого пациента совершенно по-своему, поэтому лечение требуется подбирать с учетом индивидуальных особенностей.
Перспективные направления иммунотерапии
Как и многие открытия в науке, это было сделано почти случайно. Ученые Кардиффского университета в Великобритании искали не лекарство от рака, а Т-клетки, способные бороться с бактериями. Сами по себе Т-клетки не могут нацеливаться на бактерии или вирусы напрямую, поэтому проверяют другие клетки организма, находя те, что заражены патогеном. Для этого на поверхности Т-клеток существуют специальные рецепторы, специфичные для каждого из болезнетворных агентов.
Задачей ученых было найти Т-лимфоциты, которые могли бы распознавать и уничтожать сразу несколько типов бактерий. Они взяли множество таких клеток и проверили их на эту способность. В ходе исследования было установлено, что рецептор Т-клеток (TCR) распознает и позволяет уничтожить раковые клетки большинства типов опухолей у человека. Эти данные открывают новые возможности для иммунотерапии различных видов онкологических заболеваний⁵.
Стоит отметить, что такие возможности иммунной системы уже используют в одном из видов лечения. CAR-T-терапия как раз основана на умении Т-клеток обнаруживать опухоль. Но эта способность специфична и не может быть использована для всех пациентов без разбора: типов и даже подтипов рака очень много, поэтому сложно создать адекватные мишени. Удивительным оказалось другое: ученые обнаружили Т-лимфоцитарный пул, уничтоживший вообще все опухолевые клетки, независимо от их типа, не затронув здоровые. Затем исследователи один за другим удаляли из клеток различные белки, что позволило узнать, какой именно отвечает за этот процесс. Так был обнаружен протеин MR1⁵.
Белок MR1 находится в любой клетке нашего организма, и она необязательно должна быть опухолевой. Идея ученых в том, что можно использовать обнаруженный механизм распознавания вместо того, чтобы адаптировать Т-клетки к определенному виду рака, как при CAR-T-терапии. Исследователи пока не знают, каким образом происходит передача сигнала, и испытания прошли только на мышах. Однако, даже если в итоге работа не приведет к открытию заветного лекарства от рака, она может помочь найти новые средства его лечения и расширить понимание механизмов возникновения и развития заболевания.
M-RU-00008421 Ноябрь 2022
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Coontz R. Science's Top 10 Breakthroughs of 2013. (Электронный ресурс). sciencemag.org/news/2013/12/sciences-top-10-breakthroughs-2013-0 (дата обращения: 02.09.2020).
Ichim C.V. Revisiting immunosurveillance and immunostimulation: Implications for cancer immunotherapy. J Transl Med. 2005;3:8. DOI: 10.1186/1479-5876-3-8.
Южакова Д.В., Ширманова М.В., Сергеева Т.Ф. и др. Иммунотерапия злокачественных новообразований (обзор). Современные технологии в медицине. 2016;1:173–182.
Zacharakis N., Chinnasamy H., Black M. et al. Immune recognition of somatic mutations leading to complete durable regression in metastatic breast cancer. Nat Med. 2018;24(6):724–730. DOI: 10.1038/s41591-018-0040-8.
Crowther M.D., Dolton G., Legut M. et al. Genome-wide CRISPR–Cas9 screening reveals ubiquitous T cell cancer targeting via the monomorphic MHC class I-related protein MR1. Nat Immunol. 2020;21:178–185. DOI: 10.1038/s41590-019-0578-8.
Совсем недавно американские онкологи описали первый случай ремиссии пациентки с метастатическим раком молочной железы, устойчивым к другим методам лечения. Джуди Перкинс в 49 лет диагностировали гормонозависимый рак молочной железы с метастазами в печень и другие органы. По словам женщины, врачи предполагали, что она сможет прожить не более трех лет. Однако Джуди стала участницей клинических испытаний персонализированной Т-клеточной иммунотерапии. Ей провели биопсию опухоли для поиска специфичных мутаций, а также выделили из образцов ткани инфильтрирующие опухоль лимфоциты (TILs, tumor-infiltrating lymphocytes), чтобы найти среди них неоантиген-специфические клетки.
В результате исследования специалисты обнаружили 62 специфические мутации, выделили соответствующие пептиды, «показали» их лимфоцитам пациентки при помощи антиген-презентирующих клеток, а затем отобрали только те лимфоциты, которые реагировали на представленные им пептиды. Их размножили и ввели обратно пациентке параллельно с лечением иммунотерапевтическим препаратом. Через 42 недели врачи отметили полный клинический ответ на терапию. К моменту публикации этого исследования в журнале Nature ремиссия длилась почти два года⁴.
Иммунотерапия используется в лечении множества видов онкологических заболеваний. Однако, лучшие результаты пока получены у пациентов с раком легкого и меланомой. Злокачественная опухоль развивается у каждого пациента совершенно по-своему, поэтому лечение требуется подбирать с учетом индивидуальных особенностей.
Как и многие открытия в науке, это было сделано почти случайно. Ученые Кардиффского университета в Великобритании искали не лекарство от рака, а Т-клетки, способные бороться с бактериями. Сами по себе Т-клетки не могут нацеливаться на бактерии или вирусы напрямую, поэтому проверяют другие клетки организма, находя те, что заражены патогеном. Для этого на поверхности Т-клеток существуют специальные рецепторы, специфичные для каждого из болезнетворных агентов.
Задачей ученых было найти Т-лимфоциты, которые могли бы распознавать и уничтожать сразу несколько типов бактерий. Они взяли множество таких клеток и проверили их на эту способность. В ходе исследования было установлено, что рецептор Т-клеток (TCR) распознает и позволяет уничтожить раковые клетки большинства типов опухолей у человека. Эти данные открывают новые возможности для иммунотерапии различных видов онкологических заболеваний⁵.
Стоит отметить, что такие возможности иммунной системы уже используют в одном из видов лечения. CAR-T-терапия как раз основана на умении Т-клеток обнаруживать опухоль. Но эта способность специфична и не может быть использована для всех пациентов без разбора: типов и даже подтипов рака очень много, поэтому сложно создать адекватные мишени. Удивительным оказалось другое: ученые обнаружили Т-лимфоцитарный пул, уничтоживший вообще все опухолевые клетки, независимо от их типа, не затронув здоровые. Затем исследователи один за другим удаляли из клеток различные белки, что позволило узнать, какой именно отвечает за этот процесс. Так был обнаружен протеин MR1⁵.
Белок MR1 находится в любой клетке нашего организма, и она необязательно должна быть опухолевой. Идея ученых в том, что можно использовать обнаруженный механизм распознавания вместо того, чтобы адаптировать Т-клетки к определенному виду рака, как при CAR-T-терапии. Исследователи пока не знают, каким образом происходит передача сигнала, и испытания прошли только на мышах. Однако, даже если в итоге работа не приведет к открытию заветного лекарства от рака, она может помочь найти новые средства его лечения и расширить понимание механизмов возникновения и развития заболевания.
M-RU-00008421 Ноябрь 2022
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Список литературы
Coontz R. Science's Top 10 Breakthroughs of 2013. (Электронный ресурс). sciencemag.org/news/2013/12/sciences-top-10-breakthroughs-2013-0 (дата обращения: 02.09.2020).
Ichim C.V. Revisiting immunosurveillance and immunostimulation: Implications for cancer immunotherapy. J Transl Med. 2005;3:8. DOI: 10.1186/1479-5876-3-8.
Южакова Д.В., Ширманова М.В., Сергеева Т.Ф. и др. Иммунотерапия злокачественных новообразований (обзор). Современные технологии в медицине. 2016;1:173–182.
Zacharakis N., Chinnasamy H., Black M. et al. Immune recognition of somatic mutations leading to complete durable regression in metastatic breast cancer. Nat Med. 2018;24(6):724–730. DOI: 10.1038/s41591-018-0040-8.
Crowther M.D., Dolton G., Legut M. et al. Genome-wide CRISPR–Cas9 screening reveals ubiquitous T cell cancer targeting via the monomorphic MHC class I-related protein MR1. Nat Immunol. 2020;21:178–185. DOI: 10.1038/s41590-019-0578-8.