Зачем изучать генетический профиль опухоли? Оказалось, что он помогает прицельно лечить рак. Рассказываем о том, какую роль играют генетические мутации в образовании опухоли и почему важно проводить ее комплексное геномное профилирование.
Редкие генетические мутации как мишень для прицельного лечения рака
2
Содержание статьи
Что такое генетические мутации и как они возникают? Какие бывают виды генетических мутаций? Как выявляют генетические поломки внутри клеток? Какие мутации встречаются при раке легкого? Применение КГП при опухолях с большой разнородностью (гетерогенностью) генетических изменений Опухоли центральной нервной системы Почему так важно подробное изучение генетических профилей злокачественных опухолей?
Что такое генетические мутации и как они возникают?
Прежде чем говорить о методе комплексного геномного профилирования (КГП), важно понять, какую роль играют мутации в развитии рака. Разберемся, какие виды мутаций могут встречаться при онкопатологии.
Начнем с базовых понятий. В основе любой злокачественной опухоли, как правило, лежат генетические изменения. Гены находятся внутри каждой клетки человека, и всего их насчитывается около 20 000–23 0001. Это участки ДНК (дезоксирибонуклеиновых кислот), где закодирована вся генетическая информация – своеобразная программа о росте, развитии и даже сроке жизни клеток. Именно гены определяют, в какой момент и как интенсивно клетки должны делиться. Чтобы проще было ориентироваться в генах и происходящих в них изменениях, ученые присвоили каждому название.
Мутацией называют стойкое изменение в структуре ДНК, из-за которого меняется поведение и работа клеток2. Например, появляется способность к неконтролируемому росту и делению, что бывает при раке.
Какие бывают виды генетических мутаций?
Генетические мутации могут быть наследственными или приобретенными3.

Наследственные (врожденные) мутации передаются от родителей к детям. Они исходно присутствуют в генетическом материале материнской яйцеклетки или отцовского сперматозоида. Все клетки будущего организма происходят из двух родительских клеток, и генетические поломки в одной из них могут передаваться последующим поколениям. Однако семейные формы рака (наследственные опухолевые синдромы) встречаются только в 5–10% всех случаев злокачественных опухолей3. При этом передается не сам рак, а только предрасположенность к нему.
Приобретенные (соматические) мутации не передаются от родителей, а возникают с течением времени в уже сформированном организме. Они появляются исходно в одной клетке, а затем передаются всем ее клеткам-потомкам. Приобретенные мутации встречаются гораздо чаще наследственных: практически все формы злокачественных опухолей обусловлены именно ими.
На ДНК здоровых клеток постоянно действуют так называемые мутагены: различные физические, биологические и химические факторы, которые могут приводить к генетическим поломкам4. Это могут быть рентгеновские и ультрафиолетовые лучи, электромагнитные волны, радиация, удобрения, лекарства, некоторые пищевые добавки, растворители, микробы и продукты обмена веществ. В норме организм исправляет повреждения в генах, иммунная система обнаруживает и уничтожает измененные клетки. Однако в некоторых случаях мутации закрепляются в ДНК и передаются последующим поколениям клеток. Такие соматические мутации могут приводить к образованию злокачественных опухолей.
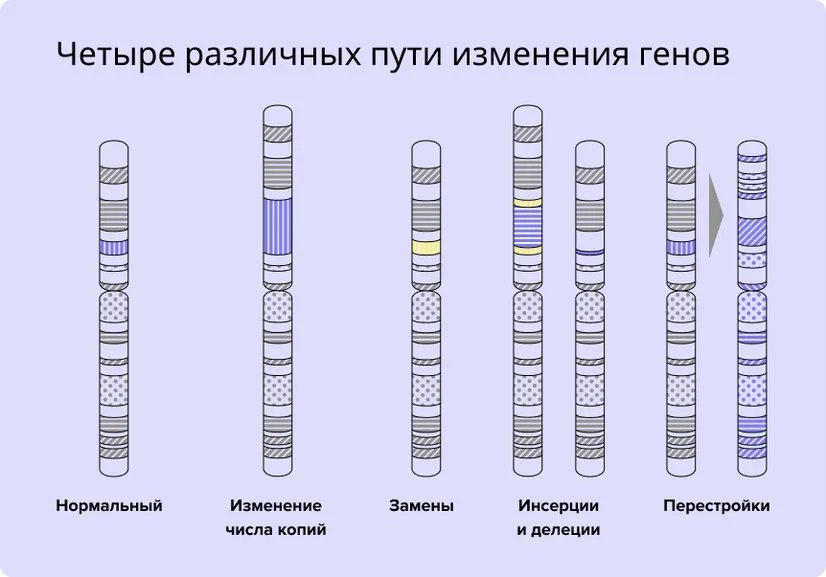
Варианты возможных генетических повреждений в клетках чрезвычайно многообразны. Рассмотрим основные виды механизмов поломок в генах4 (см. рис. 1).
Виды мутаций
- Увеличение количества копий одного гена.
- Потеря участков гена или вставка другой последовательности ДНК.
- Перенос фрагмента одного гена на другой.
- Точечные замены азотистых оснований.
Рис. 1. Четыре пути изменения генов.
Как выявляют генетические поломки внутри клеток?
Специальный молекулярно-генетический анализ выявляет мутации и помогает отличить опухолевые клетки от здоровых. Зная вид мутации, врач может подобрать лечение, которое будет прицельно действовать именно на эти злокачественные клетки5. Генетический профиль опухоли уникален у каждого конкретного пациента. Благодаря точному диагнозу врачи максимально индивидуализируют терапию, то есть назначают оптимальное лечение, подходящее именно этому пациенту.
Современные методы выявляют все типы молекулярных изменений при мутациях с высокой точностью. Их используют для уточнения генетических изменений при немелкоклеточном раке легкого, опухолях с невыявленной первичной локализацией (ОНПЛ), редких опухолях (особенно головы и шеи), холангиокарциноме, в детской онкологии (при опухолях центральной нервной системы), а также раке предстательной и молочной желез, яичника, меланоме, колоректальном раке и др.
В технологии КГП для диагностики генетических поломок используют инновационную методику секвенирования нового поколения (NGS, next generation sequencing)6, 7.
Рассмотрим генетические поломки, которые с разной частотой встречаются при некоторых видах злокачественных новообразований, и способность технологии КГП их обнаруживать.
Какие мутации встречаются при раке легкого?
За последнее десятилетие появилась новая ценная информация, которая помогла ученым глубже проникнуть в суть молекулярной биологии опухолей. Это сильно изменило перспективы и эффективность лечения рака. Если говорить, например, про рак легкого, то раньше врачам приходилось довольствоваться делением опухолей на мелкоклеточный и немелкоклеточный рак6. В некоторых случаях подобрать терапию было сложно, потому что опухоль не реагировала на лечение.
В 2004 году были впервые обнаружены активирующие мутации в гене EGFR, кодирующем особый белок под названием рецептор эпидермального фактора роста (EGFR). Чаще всего они обнаруживаются у пациентов с немелкоклеточным раком легкого, а именно аденокарциномой (около 17% всех случаев аденокарциномы)8.
КГП выявляет на 17% больше пациентов с мутациями гена EGFR по сравнению с традиционными методами генетического тестирования FISH и ПЦР9. А это означает, что эффективность лечения повышается, а количество положительных исходов увеличивается. Исследование на мутацию этого гена позволяет онкологам определять, у каких пациентов с большей долей вероятности будет положительный результат лечения с помощью определенных противоопухолевых препаратов6.
При дальнейшем изучении оказалось, что поломки могут затрагивать разные участки гена EGFR, в зависимости от этого клетки опухоли чувствительны к тем или иным лекарствам10. Раньше онкологи подбирали лечение методом проб и ошибок — если курс химиотерапии оказывался неэффективным, назначали другой. Сейчас методика КГП может помочь выбрать наиболее подходящее лечение.
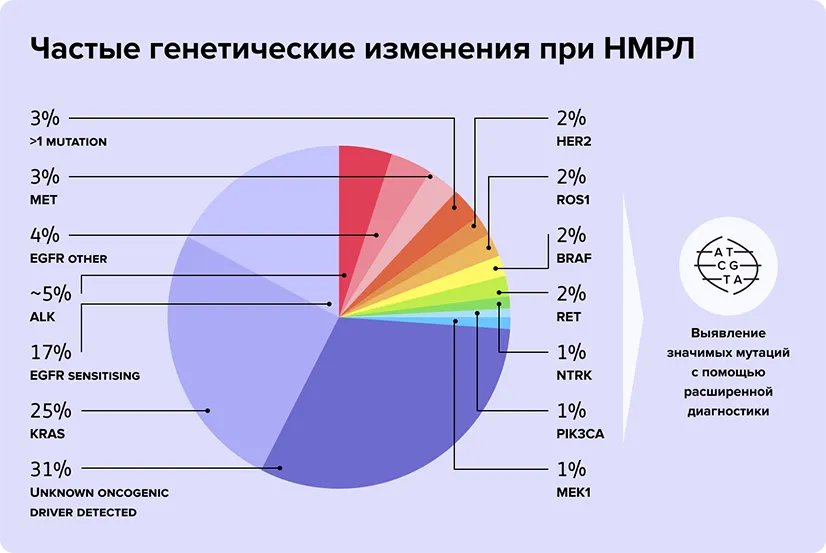
Однако поломками в гене EGFR причины развития рака легкого не ограничиваются. Позже выявили более редкие мутации, участвующие в развитии этого онкозаболевания8, 11. При аденокарциноме легкого молекулярно-генетическое тестирование позволяет выявить целый ряд других генных поломок, каждая из которых определяет чувствительность к противоопухолевым препаратам. К ним относятся, например, мутации генов ALK, MET, ROS1, RET, HER2 и BRAF (см. рис. 2).
Рис. 2. Частые генетические мутации при НРМЛ.
Применение КГП при опухолях с большой разнородностью (гетерогенностью) генетических изменений
КГП успешно применяется при опухолях с большой генетической разнородностью (гетерогенностью). Именно к таким опухолям относится рак легкого, о котором мы писали выше. Это означает, что различий много как между опухолями у разных людей (межопухолевая гетерогенность), так и внутри одной опухоли у конкретного пациента (внутриопухолевая гетерогенность)12.
Гетерогенность свойственна большинству злокачественных опухолей. Она не только затрудняет диагностику, но и снижает эффективность лечения, а иногда ухудшает прогноз. Неоднородность генетического статуса отдельных опухолевых клеток приводит к особенностям ее роста и развития. Вероятно, причина гетерогенности опухоли кроется в ее попытках подстроиться к изменяющимся условиям среды. Ведь организм борется с раком и пытается его ликвидировать. В ответ на это опухоль изменяется и пытается повысить злокачественность, например, способность распространяться по организму, однако для врачей-онкологов гетерогенность важна с практической точки зрения – она влияет на чувствительность опухоли к тому или иному виду терапии.
Одна из самых агрессивных форм злокачественных опухолей — меланома кожи — также генетически очень разнородна. Поломки при меланоме могут быть самыми разными. Чаще всего выявляют мутацию гена BRAF: она приводит к развитию меланомы кожи в 40–80% случаев. При этом на сегодняшний день обнаружено более 40 разных мутаций этого гена13.
КГП позволяет выявить на 37% больше пациентов с нарушениями структуры гена BRAF, чем другие технологии молекулярно-генетического тестирования14.
А это означает, что можно прицельно подобрать противоопухолевые препараты и затормозить рост опухоли более эффективно. Дело в том, что ученые обнаружили белки, которые образуются при мутациях гена BRAF, и придумали лекарственные молекулы, прицельно действующие на них. Однако такие препараты не будут работать при меланоме с нормальной активностью гена BRAF. Поэтому исключительно важно достоверно определить генетический статус опухоли15.
Анализ профилей генетической активности разных меланом показал, что изменения могут быть в огромном количестве – до 2 602 генов13. Они встречаются гораздо реже поломок гена BRAF.
Глубокое изучение генетического профиля опухоли помогает подобрать лечение и при холангиокарциноме (ХК), злокачественной опухоли из эпителиальных клеток желчных протоков. Внутри- и внепеченочные формы ХК различаются по клиническим и генетическим признакам, то есть являются гетерогенными16. Например, одни гены изменяются исключительно при внутрипеченочной форме ХК, тогда как при внепеченочной форме ХК выявлены мутации других генов. Правильная диагностика этих форм позволяет врачам выбрать подходящее конкретному пациенту лечение, оценить прогноз для жизни, в том числе риск рецидива после проведенной терапии.
Опухоли центральной нервной системы
Исследования генетических профилей позволили ученым и практикующим онкологам еще лучше понять, как возникают и ведут себя злокачественные опухоли центральной нервной системы (ЦНС). Специалисты ВОЗ в 2016 году выпустили новую классификацию опухолей ЦНС с учетом молекулярно генетических изменений17.
Поиск молекул (биомаркеров), которые образуются в результате работы мутантных генов, во многом определяет выбор методов лечения для разных пациентов с опухолями ЦНС18.
Почему так важно подробное изучение генетических профилей злокачественных опухолей?
Анализ 570 клинических исследований с участием более 32 тысяч пациентов с разными видами онкозаболеваний показал, что лечение на основе результатов молекулярно-генетических профилей злокачественных опухолей дает значимо лучшие результаты19. Подбор лечения на основании глубокого изучения генетических поломок предполагает лучшие исходы. Персонализированная терапия, то есть лечение с учетом индивидуальных особенностей каждого пациента, оказывается более эффективной, а количество неблагоприятных исходов, в том числе связанных с токсичностью препаратов, ниже19.
M-RU-00009636 март 2023
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Гены и хромосомы. Quasar S. Padiath, MBBS, PhD, University of Pittsburgh. Справочник MSD, пользовательская версия. Обновлено июнь, 2023. (Электронный ресурс). URL: https://www.msdmanuals.com/ru/home/ (дата обращения: 03.05.2024).
Gene mutations in non-small-cell lung cancer. Reviewed By Neha Pathak, MD on November 29, 2021. (Электронный ресурс). URL: https://www.webmd.com/lung-cancer/story/nsclc-gene-mutations (дата обращения: 03.05.2024)
Family Cancer Syndromes. Genetics and cancer. Written by The American Cancer Society medical and editorial content team. Last Revised. August 5, 2020. (Электронный ресурс). URL: https://www.cancer.org/healthy/cancer-causes/genetics/family-cancer-syndromes.html (дата обращения: 03.05.2024).
Stratton M., Campbell P. & Futreal P. The cancer genome. Nature 2009;458:719–724. (Электронный ресурс). URL: https://doi.org/10.1038/nature07943 (дата обращения: 03.05.2024).
Молекулярная диагностика рака. Информация для пациентов. ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. (Электронный ресурс). URL: https://www.niioncologii.ru/patients/additional-information/molecular-diagnostics (дата обращения: 03.05.2024).
Генетика и онкология: главные вопросы. ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. (Электронный ресурс). URL: https://nii-onco.ru/diagnostika/genetika-i-onkologiya-glavnye-voprosy/ (дата обращения: 03.05.2024).
Frampton G., Fichtenholtz A., Otto G., et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing. Nat Biotechnol. 2013;31:1023–1031. (Электронный ресурс). URL: https://doi.org/10.1038/nbt.2696 (дата обращения: 03.05.2024).
Anne S. Tsao, Giorgio V. Scagliotti, Paul A. Bunn, et al. Scientific Advances in Lung Cancer 2015. Journal of Thoracic Oncology, Elsevier. May 2016. (Электронный ресурс). URL: https://doi.org/10.1016/j.jtho.2016.03.012 (дата обращения: 03.05.2024).
Alexa B. Schrock, Garrett M. Frampton, Dana Herndon. Comprehensive Genomic Profiling Identifies Frequent Drug-Sensitive EGFR Exon 19 Deletions in NSCLC not Identified by Prior Molecular Testing. Clin Cancer Res. 2016;22(13):3281–3285. (Электронный ресурс). URL: https://doi.org/10.1158/1078-0432.CCR-15-1668 (дата обращения: 03.05.2024).
Мутации гена EGFR. Официальный сайт Программы RUSSCO. Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. (Электронный ресурс). URL: http://www.cancergenome.ru/mutations/EGFR/ (дата обращения: 03.05.2024).
Manolo D’Arcangelo, Armida D’Incecco, Federico Cappuzzo. Rare mutations in non-small-cell lung cancer. Future Oncology. 2013;9(5):699–711. (Электронный ресурс). URL: https://doi.org/10.2217/fon.13.16 (дата обращения: 03.05.2024).
Геращенко Т.С., Денисов Е.В., Литвяков Н.В. и др. Внутриопухолевая гетерогенность: природа и биологическое значение. Биохимия. 2013;78(11):1531–1549. (Электронный ресурс). URL: https://biochemistrymoscow.com/ru/archive/2013/78-11-1531/ (дата обращения: 03.05.2024).
Любченко Л.Н., Черненко П.А., Хатырев С.А. и др. Клинико-генетическая гетерогенность меланомы кожи. Молекулярно-генетические аспекты диагностики. Злокачественные опухоли. 2012;2(2).
Boussemart L., Nelson A., Wong M., et al. Hybrid Capture-Based Genomic Profiling Identifies BRAF V600 and Non-V600 Alterations in Melanoma Samples Negative by Prior Testing. Oncologist. 2019 May;24(5):657–663. DOI: 10.1634/theoncologist.2018-0271. Epub 2019 Jan 25. PMID: 30683711; PMCID: PMC6516121.
Мутация гена BRAF при меланоме. Официальный сайт Программы RUSSCO. Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. (Электронный ресурс). URL: http://www.cancergenome.ru/mutations/BRAF/melanoma/ (дата обращения: 03.05.2024).
Churi C.R., Shroff R., Wang Y., et al. Mutation profiling in cholangiocarcinoma: prognostic and therapeutic implications. PLoS One. 2014;9(12):e115383. DOI: 10.1371/journal.pone.0115383. PMID: 25536104; PMCID: PMC4275227.
Louis D.N., Perry A., Reifenberger G., et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol . 2016;131:803–820. https://doi.org/10.1007/s00401-016-1545-1.
Staedtke V., Dzaye O., Holdhoff M. Actionable molecular biomarkers in primary brain tumors. Trends Cancer. 2016 Jul;2(7):338–349. DOI: 10.1016/j.trecan.2016.06.003. PMID: 28603776; PMCID: PMC5461965.
Schwaederle M., Zhao M., Lee J.J., Eggermont A.M., Schilsky R.L., Mendelsohn J., Lazar V., Kurzrock R. Impact of Precision Medicine in Diverse Cancers: A Meta-Analysis of Phase II Clinical Trials. J Clin Oncol. 2015;33(32):3817–3825. DOI: 10.1200/JCO.2015.61.5997. Epub 2015 Aug 24. PMID: 26304871; PMCID: PMC4737863.
Прежде чем говорить о методе комплексного геномного профилирования (КГП), важно понять, какую роль играют мутации в развитии рака. Разберемся, какие виды мутаций могут встречаться при онкопатологии.
Начнем с базовых понятий. В основе любой злокачественной опухоли, как правило, лежат генетические изменения. Гены находятся внутри каждой клетки человека, и всего их насчитывается около 20 000–23 0001. Это участки ДНК (дезоксирибонуклеиновых кислот), где закодирована вся генетическая информация – своеобразная программа о росте, развитии и даже сроке жизни клеток. Именно гены определяют, в какой момент и как интенсивно клетки должны делиться. Чтобы проще было ориентироваться в генах и происходящих в них изменениях, ученые присвоили каждому название.
Мутацией называют стойкое изменение в структуре ДНК, из-за которого меняется поведение и работа клеток2. Например, появляется способность к неконтролируемому росту и делению, что бывает при раке.
Генетические мутации могут быть наследственными или приобретенными3.

Наследственные (врожденные) мутации передаются от родителей к детям. Они исходно присутствуют в генетическом материале материнской яйцеклетки или отцовского сперматозоида. Все клетки будущего организма происходят из двух родительских клеток, и генетические поломки в одной из них могут передаваться последующим поколениям. Однако семейные формы рака (наследственные опухолевые синдромы) встречаются только в 5–10% всех случаев злокачественных опухолей3. При этом передается не сам рак, а только предрасположенность к нему.

Приобретенные (соматические) мутации не передаются от родителей, а возникают с течением времени в уже сформированном организме. Они появляются исходно в одной клетке, а затем передаются всем ее клеткам-потомкам. Приобретенные мутации встречаются гораздо чаще наследственных: практически все формы злокачественных опухолей обусловлены именно ими.
На ДНК здоровых клеток постоянно действуют так называемые мутагены: различные физические, биологические и химические факторы, которые могут приводить к генетическим поломкам4. Это могут быть рентгеновские и ультрафиолетовые лучи, электромагнитные волны, радиация, удобрения, лекарства, некоторые пищевые добавки, растворители, микробы и продукты обмена веществ. В норме организм исправляет повреждения в генах, иммунная система обнаруживает и уничтожает измененные клетки. Однако в некоторых случаях мутации закрепляются в ДНК и передаются последующим поколениям клеток. Такие соматические мутации могут приводить к образованию злокачественных опухолей.
Варианты возможных генетических повреждений в клетках чрезвычайно многообразны. Рассмотрим основные виды механизмов поломок в генах4 (см. рис. 1).
Виды мутаций
- Увеличение количества копий одного гена.
- Потеря участков гена или вставка другой последовательности ДНК.
- Перенос фрагмента одного гена на другой.
- Точечные замены азотистых оснований.
Рис. 1. Четыре пути изменения генов.
Как выявляют генетические поломки внутри клеток?
Специальный молекулярно-генетический анализ выявляет мутации и помогает отличить опухолевые клетки от здоровых. Зная вид мутации, врач может подобрать лечение, которое будет прицельно действовать именно на эти злокачественные клетки5. Генетический профиль опухоли уникален у каждого конкретного пациента. Благодаря точному диагнозу врачи максимально индивидуализируют терапию, то есть назначают оптимальное лечение, подходящее именно этому пациенту.
Современные методы выявляют все типы молекулярных изменений при мутациях с высокой точностью. Их используют для уточнения генетических изменений при немелкоклеточном раке легкого, опухолях с невыявленной первичной локализацией (ОНПЛ), редких опухолях (особенно головы и шеи), холангиокарциноме, в детской онкологии (при опухолях центральной нервной системы), а также раке предстательной и молочной желез, яичника, меланоме, колоректальном раке и др.
В технологии КГП для диагностики генетических поломок используют инновационную методику секвенирования нового поколения (NGS, next generation sequencing)6, 7.
Рассмотрим генетические поломки, которые с разной частотой встречаются при некоторых видах злокачественных новообразований, и способность технологии КГП их обнаруживать.
Какие мутации встречаются при раке легкого?
За последнее десятилетие появилась новая ценная информация, которая помогла ученым глубже проникнуть в суть молекулярной биологии опухолей. Это сильно изменило перспективы и эффективность лечения рака. Если говорить, например, про рак легкого, то раньше врачам приходилось довольствоваться делением опухолей на мелкоклеточный и немелкоклеточный рак6. В некоторых случаях подобрать терапию было сложно, потому что опухоль не реагировала на лечение.
В 2004 году были впервые обнаружены активирующие мутации в гене EGFR, кодирующем особый белок под названием рецептор эпидермального фактора роста (EGFR). Чаще всего они обнаруживаются у пациентов с немелкоклеточным раком легкого, а именно аденокарциномой (около 17% всех случаев аденокарциномы)8.
КГП выявляет на 17% больше пациентов с мутациями гена EGFR по сравнению с традиционными методами генетического тестирования FISH и ПЦР9. А это означает, что эффективность лечения повышается, а количество положительных исходов увеличивается. Исследование на мутацию этого гена позволяет онкологам определять, у каких пациентов с большей долей вероятности будет положительный результат лечения с помощью определенных противоопухолевых препаратов6.
При дальнейшем изучении оказалось, что поломки могут затрагивать разные участки гена EGFR, в зависимости от этого клетки опухоли чувствительны к тем или иным лекарствам10. Раньше онкологи подбирали лечение методом проб и ошибок — если курс химиотерапии оказывался неэффективным, назначали другой. Сейчас методика КГП может помочь выбрать наиболее подходящее лечение.
Однако поломками в гене EGFR причины развития рака легкого не ограничиваются. Позже выявили более редкие мутации, участвующие в развитии этого онкозаболевания8, 11. При аденокарциноме легкого молекулярно-генетическое тестирование позволяет выявить целый ряд других генных поломок, каждая из которых определяет чувствительность к противоопухолевым препаратам. К ним относятся, например, мутации генов ALK, MET, ROS1, RET, HER2 и BRAF (см. рис. 2).
Рис. 2. Частые генетические мутации при НРМЛ.
Применение КГП при опухолях с большой разнородностью (гетерогенностью) генетических изменений
КГП успешно применяется при опухолях с большой генетической разнородностью (гетерогенностью). Именно к таким опухолям относится рак легкого, о котором мы писали выше. Это означает, что различий много как между опухолями у разных людей (межопухолевая гетерогенность), так и внутри одной опухоли у конкретного пациента (внутриопухолевая гетерогенность)12.
Гетерогенность свойственна большинству злокачественных опухолей. Она не только затрудняет диагностику, но и снижает эффективность лечения, а иногда ухудшает прогноз. Неоднородность генетического статуса отдельных опухолевых клеток приводит к особенностям ее роста и развития. Вероятно, причина гетерогенности опухоли кроется в ее попытках подстроиться к изменяющимся условиям среды. Ведь организм борется с раком и пытается его ликвидировать. В ответ на это опухоль изменяется и пытается повысить злокачественность, например, способность распространяться по организму, однако для врачей-онкологов гетерогенность важна с практической точки зрения – она влияет на чувствительность опухоли к тому или иному виду терапии.
Одна из самых агрессивных форм злокачественных опухолей — меланома кожи — также генетически очень разнородна. Поломки при меланоме могут быть самыми разными. Чаще всего выявляют мутацию гена BRAF: она приводит к развитию меланомы кожи в 40–80% случаев. При этом на сегодняшний день обнаружено более 40 разных мутаций этого гена13.
КГП позволяет выявить на 37% больше пациентов с нарушениями структуры гена BRAF, чем другие технологии молекулярно-генетического тестирования14.
А это означает, что можно прицельно подобрать противоопухолевые препараты и затормозить рост опухоли более эффективно. Дело в том, что ученые обнаружили белки, которые образуются при мутациях гена BRAF, и придумали лекарственные молекулы, прицельно действующие на них. Однако такие препараты не будут работать при меланоме с нормальной активностью гена BRAF. Поэтому исключительно важно достоверно определить генетический статус опухоли15.
Анализ профилей генетической активности разных меланом показал, что изменения могут быть в огромном количестве – до 2 602 генов13. Они встречаются гораздо реже поломок гена BRAF.
Глубокое изучение генетического профиля опухоли помогает подобрать лечение и при холангиокарциноме (ХК), злокачественной опухоли из эпителиальных клеток желчных протоков. Внутри- и внепеченочные формы ХК различаются по клиническим и генетическим признакам, то есть являются гетерогенными16. Например, одни гены изменяются исключительно при внутрипеченочной форме ХК, тогда как при внепеченочной форме ХК выявлены мутации других генов. Правильная диагностика этих форм позволяет врачам выбрать подходящее конкретному пациенту лечение, оценить прогноз для жизни, в том числе риск рецидива после проведенной терапии.
Опухоли центральной нервной системы
Исследования генетических профилей позволили ученым и практикующим онкологам еще лучше понять, как возникают и ведут себя злокачественные опухоли центральной нервной системы (ЦНС). Специалисты ВОЗ в 2016 году выпустили новую классификацию опухолей ЦНС с учетом молекулярно генетических изменений17.
Поиск молекул (биомаркеров), которые образуются в результате работы мутантных генов, во многом определяет выбор методов лечения для разных пациентов с опухолями ЦНС18.
Почему так важно подробное изучение генетических профилей злокачественных опухолей?
Анализ 570 клинических исследований с участием более 32 тысяч пациентов с разными видами онкозаболеваний показал, что лечение на основе результатов молекулярно-генетических профилей злокачественных опухолей дает значимо лучшие результаты19. Подбор лечения на основании глубокого изучения генетических поломок предполагает лучшие исходы. Персонализированная терапия, то есть лечение с учетом индивидуальных особенностей каждого пациента, оказывается более эффективной, а количество неблагоприятных исходов, в том числе связанных с токсичностью препаратов, ниже19.
M-RU-00009636 март 2023
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Гены и хромосомы. Quasar S. Padiath, MBBS, PhD, University of Pittsburgh. Справочник MSD, пользовательская версия. Обновлено июнь, 2023. (Электронный ресурс). URL: https://www.msdmanuals.com/ru/home/ (дата обращения: 03.05.2024).
Gene mutations in non-small-cell lung cancer. Reviewed By Neha Pathak, MD on November 29, 2021. (Электронный ресурс). URL: https://www.webmd.com/lung-cancer/story/nsclc-gene-mutations (дата обращения: 03.05.2024)
Family Cancer Syndromes. Genetics and cancer. Written by The American Cancer Society medical and editorial content team. Last Revised. August 5, 2020. (Электронный ресурс). URL: https://www.cancer.org/healthy/cancer-causes/genetics/family-cancer-syndromes.html (дата обращения: 03.05.2024).
Stratton M., Campbell P. & Futreal P. The cancer genome. Nature 2009;458:719–724. (Электронный ресурс). URL: https://doi.org/10.1038/nature07943 (дата обращения: 03.05.2024).
Молекулярная диагностика рака. Информация для пациентов. ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. (Электронный ресурс). URL: https://www.niioncologii.ru/patients/additional-information/molecular-diagnostics (дата обращения: 03.05.2024).
Генетика и онкология: главные вопросы. ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. (Электронный ресурс). URL: https://nii-onco.ru/diagnostika/genetika-i-onkologiya-glavnye-voprosy/ (дата обращения: 03.05.2024).
Frampton G., Fichtenholtz A., Otto G., et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing. Nat Biotechnol. 2013;31:1023–1031. (Электронный ресурс). URL: https://doi.org/10.1038/nbt.2696 (дата обращения: 03.05.2024).
Anne S. Tsao, Giorgio V. Scagliotti, Paul A. Bunn, et al. Scientific Advances in Lung Cancer 2015. Journal of Thoracic Oncology, Elsevier. May 2016. (Электронный ресурс). URL: https://doi.org/10.1016/j.jtho.2016.03.012 (дата обращения: 03.05.2024).
Alexa B. Schrock, Garrett M. Frampton, Dana Herndon. Comprehensive Genomic Profiling Identifies Frequent Drug-Sensitive EGFR Exon 19 Deletions in NSCLC not Identified by Prior Molecular Testing. Clin Cancer Res. 2016;22(13):3281–3285. (Электронный ресурс). URL: https://doi.org/10.1158/1078-0432.CCR-15-1668 (дата обращения: 03.05.2024).
Мутации гена EGFR. Официальный сайт Программы RUSSCO. Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. (Электронный ресурс). URL: http://www.cancergenome.ru/mutations/EGFR/ (дата обращения: 03.05.2024).
Manolo D’Arcangelo, Armida D’Incecco, Federico Cappuzzo. Rare mutations in non-small-cell lung cancer. Future Oncology. 2013;9(5):699–711. (Электронный ресурс). URL: https://doi.org/10.2217/fon.13.16 (дата обращения: 03.05.2024).
Геращенко Т.С., Денисов Е.В., Литвяков Н.В. и др. Внутриопухолевая гетерогенность: природа и биологическое значение. Биохимия. 2013;78(11):1531–1549. (Электронный ресурс). URL: https://biochemistrymoscow.com/ru/archive/2013/78-11-1531/ (дата обращения: 03.05.2024).
Любченко Л.Н., Черненко П.А., Хатырев С.А. и др. Клинико-генетическая гетерогенность меланомы кожи. Молекулярно-генетические аспекты диагностики. Злокачественные опухоли. 2012;2(2).
Boussemart L., Nelson A., Wong M., et al. Hybrid Capture-Based Genomic Profiling Identifies BRAF V600 and Non-V600 Alterations in Melanoma Samples Negative by Prior Testing. Oncologist. 2019 May;24(5):657–663. DOI: 10.1634/theoncologist.2018-0271. Epub 2019 Jan 25. PMID: 30683711; PMCID: PMC6516121.
Мутация гена BRAF при меланоме. Официальный сайт Программы RUSSCO. Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. (Электронный ресурс). URL: http://www.cancergenome.ru/mutations/BRAF/melanoma/ (дата обращения: 03.05.2024).
Churi C.R., Shroff R., Wang Y., et al. Mutation profiling in cholangiocarcinoma: prognostic and therapeutic implications. PLoS One. 2014;9(12):e115383. DOI: 10.1371/journal.pone.0115383. PMID: 25536104; PMCID: PMC4275227.
Louis D.N., Perry A., Reifenberger G., et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol . 2016;131:803–820. https://doi.org/10.1007/s00401-016-1545-1.
Staedtke V., Dzaye O., Holdhoff M. Actionable molecular biomarkers in primary brain tumors. Trends Cancer. 2016 Jul;2(7):338–349. DOI: 10.1016/j.trecan.2016.06.003. PMID: 28603776; PMCID: PMC5461965.
Schwaederle M., Zhao M., Lee J.J., Eggermont A.M., Schilsky R.L., Mendelsohn J., Lazar V., Kurzrock R. Impact of Precision Medicine in Diverse Cancers: A Meta-Analysis of Phase II Clinical Trials. J Clin Oncol. 2015;33(32):3817–3825. DOI: 10.1200/JCO.2015.61.5997. Epub 2015 Aug 24. PMID: 26304871; PMCID: PMC4737863.
Специальный молекулярно-генетический анализ выявляет мутации и помогает отличить опухолевые клетки от здоровых. Зная вид мутации, врач может подобрать лечение, которое будет прицельно действовать именно на эти злокачественные клетки5. Генетический профиль опухоли уникален у каждого конкретного пациента. Благодаря точному диагнозу врачи максимально индивидуализируют терапию, то есть назначают оптимальное лечение, подходящее именно этому пациенту.
Современные методы выявляют все типы молекулярных изменений при мутациях с высокой точностью. Их используют для уточнения генетических изменений при немелкоклеточном раке легкого, опухолях с невыявленной первичной локализацией (ОНПЛ), редких опухолях (особенно головы и шеи), холангиокарциноме, в детской онкологии (при опухолях центральной нервной системы), а также раке предстательной и молочной желез, яичника, меланоме, колоректальном раке и др.
В технологии КГП для диагностики генетических поломок используют инновационную методику секвенирования нового поколения (NGS, next generation sequencing)6, 7.
Рассмотрим генетические поломки, которые с разной частотой встречаются при некоторых видах злокачественных новообразований, и способность технологии КГП их обнаруживать.
За последнее десятилетие появилась новая ценная информация, которая помогла ученым глубже проникнуть в суть молекулярной биологии опухолей. Это сильно изменило перспективы и эффективность лечения рака. Если говорить, например, про рак легкого, то раньше врачам приходилось довольствоваться делением опухолей на мелкоклеточный и немелкоклеточный рак6. В некоторых случаях подобрать терапию было сложно, потому что опухоль не реагировала на лечение.
В 2004 году были впервые обнаружены активирующие мутации в гене EGFR, кодирующем особый белок под названием рецептор эпидермального фактора роста (EGFR). Чаще всего они обнаруживаются у пациентов с немелкоклеточным раком легкого, а именно аденокарциномой (около 17% всех случаев аденокарциномы)8.
КГП выявляет на 17% больше пациентов с мутациями гена EGFR по сравнению с традиционными методами генетического тестирования FISH и ПЦР9. А это означает, что эффективность лечения повышается, а количество положительных исходов увеличивается. Исследование на мутацию этого гена позволяет онкологам определять, у каких пациентов с большей долей вероятности будет положительный результат лечения с помощью определенных противоопухолевых препаратов6.
При дальнейшем изучении оказалось, что поломки могут затрагивать разные участки гена EGFR, в зависимости от этого клетки опухоли чувствительны к тем или иным лекарствам10. Раньше онкологи подбирали лечение методом проб и ошибок — если курс химиотерапии оказывался неэффективным, назначали другой. Сейчас методика КГП может помочь выбрать наиболее подходящее лечение.
Однако поломками в гене EGFR причины развития рака легкого не ограничиваются. Позже выявили более редкие мутации, участвующие в развитии этого онкозаболевания8, 11. При аденокарциноме легкого молекулярно-генетическое тестирование позволяет выявить целый ряд других генных поломок, каждая из которых определяет чувствительность к противоопухолевым препаратам. К ним относятся, например, мутации генов ALK, MET, ROS1, RET, HER2 и BRAF (см. рис. 2).
Рис. 2. Частые генетические мутации при НРМЛ.
Применение КГП при опухолях с большой разнородностью (гетерогенностью) генетических изменений
КГП успешно применяется при опухолях с большой генетической разнородностью (гетерогенностью). Именно к таким опухолям относится рак легкого, о котором мы писали выше. Это означает, что различий много как между опухолями у разных людей (межопухолевая гетерогенность), так и внутри одной опухоли у конкретного пациента (внутриопухолевая гетерогенность)12.
Гетерогенность свойственна большинству злокачественных опухолей. Она не только затрудняет диагностику, но и снижает эффективность лечения, а иногда ухудшает прогноз. Неоднородность генетического статуса отдельных опухолевых клеток приводит к особенностям ее роста и развития. Вероятно, причина гетерогенности опухоли кроется в ее попытках подстроиться к изменяющимся условиям среды. Ведь организм борется с раком и пытается его ликвидировать. В ответ на это опухоль изменяется и пытается повысить злокачественность, например, способность распространяться по организму, однако для врачей-онкологов гетерогенность важна с практической точки зрения – она влияет на чувствительность опухоли к тому или иному виду терапии.
Одна из самых агрессивных форм злокачественных опухолей — меланома кожи — также генетически очень разнородна. Поломки при меланоме могут быть самыми разными. Чаще всего выявляют мутацию гена BRAF: она приводит к развитию меланомы кожи в 40–80% случаев. При этом на сегодняшний день обнаружено более 40 разных мутаций этого гена13.
КГП позволяет выявить на 37% больше пациентов с нарушениями структуры гена BRAF, чем другие технологии молекулярно-генетического тестирования14.
А это означает, что можно прицельно подобрать противоопухолевые препараты и затормозить рост опухоли более эффективно. Дело в том, что ученые обнаружили белки, которые образуются при мутациях гена BRAF, и придумали лекарственные молекулы, прицельно действующие на них. Однако такие препараты не будут работать при меланоме с нормальной активностью гена BRAF. Поэтому исключительно важно достоверно определить генетический статус опухоли15.
Анализ профилей генетической активности разных меланом показал, что изменения могут быть в огромном количестве – до 2 602 генов13. Они встречаются гораздо реже поломок гена BRAF.
Глубокое изучение генетического профиля опухоли помогает подобрать лечение и при холангиокарциноме (ХК), злокачественной опухоли из эпителиальных клеток желчных протоков. Внутри- и внепеченочные формы ХК различаются по клиническим и генетическим признакам, то есть являются гетерогенными16. Например, одни гены изменяются исключительно при внутрипеченочной форме ХК, тогда как при внепеченочной форме ХК выявлены мутации других генов. Правильная диагностика этих форм позволяет врачам выбрать подходящее конкретному пациенту лечение, оценить прогноз для жизни, в том числе риск рецидива после проведенной терапии.
Опухоли центральной нервной системы
Исследования генетических профилей позволили ученым и практикующим онкологам еще лучше понять, как возникают и ведут себя злокачественные опухоли центральной нервной системы (ЦНС). Специалисты ВОЗ в 2016 году выпустили новую классификацию опухолей ЦНС с учетом молекулярно генетических изменений17.
Поиск молекул (биомаркеров), которые образуются в результате работы мутантных генов, во многом определяет выбор методов лечения для разных пациентов с опухолями ЦНС18.
Почему так важно подробное изучение генетических профилей злокачественных опухолей?
Анализ 570 клинических исследований с участием более 32 тысяч пациентов с разными видами онкозаболеваний показал, что лечение на основе результатов молекулярно-генетических профилей злокачественных опухолей дает значимо лучшие результаты19. Подбор лечения на основании глубокого изучения генетических поломок предполагает лучшие исходы. Персонализированная терапия, то есть лечение с учетом индивидуальных особенностей каждого пациента, оказывается более эффективной, а количество неблагоприятных исходов, в том числе связанных с токсичностью препаратов, ниже19.
M-RU-00009636 март 2023
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Гены и хромосомы. Quasar S. Padiath, MBBS, PhD, University of Pittsburgh. Справочник MSD, пользовательская версия. Обновлено июнь, 2023. (Электронный ресурс). URL: https://www.msdmanuals.com/ru/home/ (дата обращения: 03.05.2024).
Gene mutations in non-small-cell lung cancer. Reviewed By Neha Pathak, MD on November 29, 2021. (Электронный ресурс). URL: https://www.webmd.com/lung-cancer/story/nsclc-gene-mutations (дата обращения: 03.05.2024)
Family Cancer Syndromes. Genetics and cancer. Written by The American Cancer Society medical and editorial content team. Last Revised. August 5, 2020. (Электронный ресурс). URL: https://www.cancer.org/healthy/cancer-causes/genetics/family-cancer-syndromes.html (дата обращения: 03.05.2024).
Stratton M., Campbell P. & Futreal P. The cancer genome. Nature 2009;458:719–724. (Электронный ресурс). URL: https://doi.org/10.1038/nature07943 (дата обращения: 03.05.2024).
Молекулярная диагностика рака. Информация для пациентов. ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. (Электронный ресурс). URL: https://www.niioncologii.ru/patients/additional-information/molecular-diagnostics (дата обращения: 03.05.2024).
Генетика и онкология: главные вопросы. ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. (Электронный ресурс). URL: https://nii-onco.ru/diagnostika/genetika-i-onkologiya-glavnye-voprosy/ (дата обращения: 03.05.2024).
Frampton G., Fichtenholtz A., Otto G., et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing. Nat Biotechnol. 2013;31:1023–1031. (Электронный ресурс). URL: https://doi.org/10.1038/nbt.2696 (дата обращения: 03.05.2024).
Anne S. Tsao, Giorgio V. Scagliotti, Paul A. Bunn, et al. Scientific Advances in Lung Cancer 2015. Journal of Thoracic Oncology, Elsevier. May 2016. (Электронный ресурс). URL: https://doi.org/10.1016/j.jtho.2016.03.012 (дата обращения: 03.05.2024).
Alexa B. Schrock, Garrett M. Frampton, Dana Herndon. Comprehensive Genomic Profiling Identifies Frequent Drug-Sensitive EGFR Exon 19 Deletions in NSCLC not Identified by Prior Molecular Testing. Clin Cancer Res. 2016;22(13):3281–3285. (Электронный ресурс). URL: https://doi.org/10.1158/1078-0432.CCR-15-1668 (дата обращения: 03.05.2024).
Мутации гена EGFR. Официальный сайт Программы RUSSCO. Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. (Электронный ресурс). URL: http://www.cancergenome.ru/mutations/EGFR/ (дата обращения: 03.05.2024).
Manolo D’Arcangelo, Armida D’Incecco, Federico Cappuzzo. Rare mutations in non-small-cell lung cancer. Future Oncology. 2013;9(5):699–711. (Электронный ресурс). URL: https://doi.org/10.2217/fon.13.16 (дата обращения: 03.05.2024).
Геращенко Т.С., Денисов Е.В., Литвяков Н.В. и др. Внутриопухолевая гетерогенность: природа и биологическое значение. Биохимия. 2013;78(11):1531–1549. (Электронный ресурс). URL: https://biochemistrymoscow.com/ru/archive/2013/78-11-1531/ (дата обращения: 03.05.2024).
Любченко Л.Н., Черненко П.А., Хатырев С.А. и др. Клинико-генетическая гетерогенность меланомы кожи. Молекулярно-генетические аспекты диагностики. Злокачественные опухоли. 2012;2(2).
Boussemart L., Nelson A., Wong M., et al. Hybrid Capture-Based Genomic Profiling Identifies BRAF V600 and Non-V600 Alterations in Melanoma Samples Negative by Prior Testing. Oncologist. 2019 May;24(5):657–663. DOI: 10.1634/theoncologist.2018-0271. Epub 2019 Jan 25. PMID: 30683711; PMCID: PMC6516121.
Мутация гена BRAF при меланоме. Официальный сайт Программы RUSSCO. Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. (Электронный ресурс). URL: http://www.cancergenome.ru/mutations/BRAF/melanoma/ (дата обращения: 03.05.2024).
Churi C.R., Shroff R., Wang Y., et al. Mutation profiling in cholangiocarcinoma: prognostic and therapeutic implications. PLoS One. 2014;9(12):e115383. DOI: 10.1371/journal.pone.0115383. PMID: 25536104; PMCID: PMC4275227.
Louis D.N., Perry A., Reifenberger G., et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol . 2016;131:803–820. https://doi.org/10.1007/s00401-016-1545-1.
Staedtke V., Dzaye O., Holdhoff M. Actionable molecular biomarkers in primary brain tumors. Trends Cancer. 2016 Jul;2(7):338–349. DOI: 10.1016/j.trecan.2016.06.003. PMID: 28603776; PMCID: PMC5461965.
Schwaederle M., Zhao M., Lee J.J., Eggermont A.M., Schilsky R.L., Mendelsohn J., Lazar V., Kurzrock R. Impact of Precision Medicine in Diverse Cancers: A Meta-Analysis of Phase II Clinical Trials. J Clin Oncol. 2015;33(32):3817–3825. DOI: 10.1200/JCO.2015.61.5997. Epub 2015 Aug 24. PMID: 26304871; PMCID: PMC4737863.
КГП успешно применяется при опухолях с большой генетической разнородностью (гетерогенностью). Именно к таким опухолям относится рак легкого, о котором мы писали выше. Это означает, что различий много как между опухолями у разных людей (межопухолевая гетерогенность), так и внутри одной опухоли у конкретного пациента (внутриопухолевая гетерогенность)12.
Гетерогенность свойственна большинству злокачественных опухолей. Она не только затрудняет диагностику, но и снижает эффективность лечения, а иногда ухудшает прогноз. Неоднородность генетического статуса отдельных опухолевых клеток приводит к особенностям ее роста и развития. Вероятно, причина гетерогенности опухоли кроется в ее попытках подстроиться к изменяющимся условиям среды. Ведь организм борется с раком и пытается его ликвидировать. В ответ на это опухоль изменяется и пытается повысить злокачественность, например, способность распространяться по организму, однако для врачей-онкологов гетерогенность важна с практической точки зрения – она влияет на чувствительность опухоли к тому или иному виду терапии.
Одна из самых агрессивных форм злокачественных опухолей — меланома кожи — также генетически очень разнородна. Поломки при меланоме могут быть самыми разными. Чаще всего выявляют мутацию гена BRAF: она приводит к развитию меланомы кожи в 40–80% случаев. При этом на сегодняшний день обнаружено более 40 разных мутаций этого гена13.
КГП позволяет выявить на 37% больше пациентов с нарушениями структуры гена BRAF, чем другие технологии молекулярно-генетического тестирования14.
А это означает, что можно прицельно подобрать противоопухолевые препараты и затормозить рост опухоли более эффективно. Дело в том, что ученые обнаружили белки, которые образуются при мутациях гена BRAF, и придумали лекарственные молекулы, прицельно действующие на них. Однако такие препараты не будут работать при меланоме с нормальной активностью гена BRAF. Поэтому исключительно важно достоверно определить генетический статус опухоли15.
Анализ профилей генетической активности разных меланом показал, что изменения могут быть в огромном количестве – до 2 602 генов13. Они встречаются гораздо реже поломок гена BRAF.
Глубокое изучение генетического профиля опухоли помогает подобрать лечение и при холангиокарциноме (ХК), злокачественной опухоли из эпителиальных клеток желчных протоков. Внутри- и внепеченочные формы ХК различаются по клиническим и генетическим признакам, то есть являются гетерогенными16. Например, одни гены изменяются исключительно при внутрипеченочной форме ХК, тогда как при внепеченочной форме ХК выявлены мутации других генов. Правильная диагностика этих форм позволяет врачам выбрать подходящее конкретному пациенту лечение, оценить прогноз для жизни, в том числе риск рецидива после проведенной терапии.
Исследования генетических профилей позволили ученым и практикующим онкологам еще лучше понять, как возникают и ведут себя злокачественные опухоли центральной нервной системы (ЦНС). Специалисты ВОЗ в 2016 году выпустили новую классификацию опухолей ЦНС с учетом молекулярно генетических изменений17.
Поиск молекул (биомаркеров), которые образуются в результате работы мутантных генов, во многом определяет выбор методов лечения для разных пациентов с опухолями ЦНС18.
Почему так важно подробное изучение генетических профилей злокачественных опухолей?
Анализ 570 клинических исследований с участием более 32 тысяч пациентов с разными видами онкозаболеваний показал, что лечение на основе результатов молекулярно-генетических профилей злокачественных опухолей дает значимо лучшие результаты19. Подбор лечения на основании глубокого изучения генетических поломок предполагает лучшие исходы. Персонализированная терапия, то есть лечение с учетом индивидуальных особенностей каждого пациента, оказывается более эффективной, а количество неблагоприятных исходов, в том числе связанных с токсичностью препаратов, ниже19.
M-RU-00009636 март 2023
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Гены и хромосомы. Quasar S. Padiath, MBBS, PhD, University of Pittsburgh. Справочник MSD, пользовательская версия. Обновлено июнь, 2023. (Электронный ресурс). URL: https://www.msdmanuals.com/ru/home/ (дата обращения: 03.05.2024).
Gene mutations in non-small-cell lung cancer. Reviewed By Neha Pathak, MD on November 29, 2021. (Электронный ресурс). URL: https://www.webmd.com/lung-cancer/story/nsclc-gene-mutations (дата обращения: 03.05.2024)
Family Cancer Syndromes. Genetics and cancer. Written by The American Cancer Society medical and editorial content team. Last Revised. August 5, 2020. (Электронный ресурс). URL: https://www.cancer.org/healthy/cancer-causes/genetics/family-cancer-syndromes.html (дата обращения: 03.05.2024).
Stratton M., Campbell P. & Futreal P. The cancer genome. Nature 2009;458:719–724. (Электронный ресурс). URL: https://doi.org/10.1038/nature07943 (дата обращения: 03.05.2024).
Молекулярная диагностика рака. Информация для пациентов. ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. (Электронный ресурс). URL: https://www.niioncologii.ru/patients/additional-information/molecular-diagnostics (дата обращения: 03.05.2024).
Генетика и онкология: главные вопросы. ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. (Электронный ресурс). URL: https://nii-onco.ru/diagnostika/genetika-i-onkologiya-glavnye-voprosy/ (дата обращения: 03.05.2024).
Frampton G., Fichtenholtz A., Otto G., et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing. Nat Biotechnol. 2013;31:1023–1031. (Электронный ресурс). URL: https://doi.org/10.1038/nbt.2696 (дата обращения: 03.05.2024).
Anne S. Tsao, Giorgio V. Scagliotti, Paul A. Bunn, et al. Scientific Advances in Lung Cancer 2015. Journal of Thoracic Oncology, Elsevier. May 2016. (Электронный ресурс). URL: https://doi.org/10.1016/j.jtho.2016.03.012 (дата обращения: 03.05.2024).
Alexa B. Schrock, Garrett M. Frampton, Dana Herndon. Comprehensive Genomic Profiling Identifies Frequent Drug-Sensitive EGFR Exon 19 Deletions in NSCLC not Identified by Prior Molecular Testing. Clin Cancer Res. 2016;22(13):3281–3285. (Электронный ресурс). URL: https://doi.org/10.1158/1078-0432.CCR-15-1668 (дата обращения: 03.05.2024).
Мутации гена EGFR. Официальный сайт Программы RUSSCO. Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. (Электронный ресурс). URL: http://www.cancergenome.ru/mutations/EGFR/ (дата обращения: 03.05.2024).
Manolo D’Arcangelo, Armida D’Incecco, Federico Cappuzzo. Rare mutations in non-small-cell lung cancer. Future Oncology. 2013;9(5):699–711. (Электронный ресурс). URL: https://doi.org/10.2217/fon.13.16 (дата обращения: 03.05.2024).
Геращенко Т.С., Денисов Е.В., Литвяков Н.В. и др. Внутриопухолевая гетерогенность: природа и биологическое значение. Биохимия. 2013;78(11):1531–1549. (Электронный ресурс). URL: https://biochemistrymoscow.com/ru/archive/2013/78-11-1531/ (дата обращения: 03.05.2024).
Любченко Л.Н., Черненко П.А., Хатырев С.А. и др. Клинико-генетическая гетерогенность меланомы кожи. Молекулярно-генетические аспекты диагностики. Злокачественные опухоли. 2012;2(2).
Boussemart L., Nelson A., Wong M., et al. Hybrid Capture-Based Genomic Profiling Identifies BRAF V600 and Non-V600 Alterations in Melanoma Samples Negative by Prior Testing. Oncologist. 2019 May;24(5):657–663. DOI: 10.1634/theoncologist.2018-0271. Epub 2019 Jan 25. PMID: 30683711; PMCID: PMC6516121.
Мутация гена BRAF при меланоме. Официальный сайт Программы RUSSCO. Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. (Электронный ресурс). URL: http://www.cancergenome.ru/mutations/BRAF/melanoma/ (дата обращения: 03.05.2024).
Churi C.R., Shroff R., Wang Y., et al. Mutation profiling in cholangiocarcinoma: prognostic and therapeutic implications. PLoS One. 2014;9(12):e115383. DOI: 10.1371/journal.pone.0115383. PMID: 25536104; PMCID: PMC4275227.
Louis D.N., Perry A., Reifenberger G., et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol . 2016;131:803–820. https://doi.org/10.1007/s00401-016-1545-1.
Staedtke V., Dzaye O., Holdhoff M. Actionable molecular biomarkers in primary brain tumors. Trends Cancer. 2016 Jul;2(7):338–349. DOI: 10.1016/j.trecan.2016.06.003. PMID: 28603776; PMCID: PMC5461965.
Schwaederle M., Zhao M., Lee J.J., Eggermont A.M., Schilsky R.L., Mendelsohn J., Lazar V., Kurzrock R. Impact of Precision Medicine in Diverse Cancers: A Meta-Analysis of Phase II Clinical Trials. J Clin Oncol. 2015;33(32):3817–3825. DOI: 10.1200/JCO.2015.61.5997. Epub 2015 Aug 24. PMID: 26304871; PMCID: PMC4737863.
Анализ 570 клинических исследований с участием более 32 тысяч пациентов с разными видами онкозаболеваний показал, что лечение на основе результатов молекулярно-генетических профилей злокачественных опухолей дает значимо лучшие результаты19. Подбор лечения на основании глубокого изучения генетических поломок предполагает лучшие исходы. Персонализированная терапия, то есть лечение с учетом индивидуальных особенностей каждого пациента, оказывается более эффективной, а количество неблагоприятных исходов, в том числе связанных с токсичностью препаратов, ниже19.
M-RU-00009636 март 2023
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Список литературы
Гены и хромосомы. Quasar S. Padiath, MBBS, PhD, University of Pittsburgh. Справочник MSD, пользовательская версия. Обновлено июнь, 2023. (Электронный ресурс). URL: https://www.msdmanuals.com/ru/home/ (дата обращения: 03.05.2024).
Gene mutations in non-small-cell lung cancer. Reviewed By Neha Pathak, MD on November 29, 2021. (Электронный ресурс). URL: https://www.webmd.com/lung-cancer/story/nsclc-gene-mutations (дата обращения: 03.05.2024)
Family Cancer Syndromes. Genetics and cancer. Written by The American Cancer Society medical and editorial content team. Last Revised. August 5, 2020. (Электронный ресурс). URL: https://www.cancer.org/healthy/cancer-causes/genetics/family-cancer-syndromes.html (дата обращения: 03.05.2024).
Stratton M., Campbell P. & Futreal P. The cancer genome. Nature 2009;458:719–724. (Электронный ресурс). URL: https://doi.org/10.1038/nature07943 (дата обращения: 03.05.2024).
Молекулярная диагностика рака. Информация для пациентов. ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. (Электронный ресурс). URL: https://www.niioncologii.ru/patients/additional-information/molecular-diagnostics (дата обращения: 03.05.2024).
Генетика и онкология: главные вопросы. ФГБУ НМИЦ онкологии им. Н.Н. Петрова Минздрава РФ. (Электронный ресурс). URL: https://nii-onco.ru/diagnostika/genetika-i-onkologiya-glavnye-voprosy/ (дата обращения: 03.05.2024).
Frampton G., Fichtenholtz A., Otto G., et al. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing. Nat Biotechnol. 2013;31:1023–1031. (Электронный ресурс). URL: https://doi.org/10.1038/nbt.2696 (дата обращения: 03.05.2024).
Anne S. Tsao, Giorgio V. Scagliotti, Paul A. Bunn, et al. Scientific Advances in Lung Cancer 2015. Journal of Thoracic Oncology, Elsevier. May 2016. (Электронный ресурс). URL: https://doi.org/10.1016/j.jtho.2016.03.012 (дата обращения: 03.05.2024).
Alexa B. Schrock, Garrett M. Frampton, Dana Herndon. Comprehensive Genomic Profiling Identifies Frequent Drug-Sensitive EGFR Exon 19 Deletions in NSCLC not Identified by Prior Molecular Testing. Clin Cancer Res. 2016;22(13):3281–3285. (Электронный ресурс). URL: https://doi.org/10.1158/1078-0432.CCR-15-1668 (дата обращения: 03.05.2024).
Мутации гена EGFR. Официальный сайт Программы RUSSCO. Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. (Электронный ресурс). URL: http://www.cancergenome.ru/mutations/EGFR/ (дата обращения: 03.05.2024).
Manolo D’Arcangelo, Armida D’Incecco, Federico Cappuzzo. Rare mutations in non-small-cell lung cancer. Future Oncology. 2013;9(5):699–711. (Электронный ресурс). URL: https://doi.org/10.2217/fon.13.16 (дата обращения: 03.05.2024).
Геращенко Т.С., Денисов Е.В., Литвяков Н.В. и др. Внутриопухолевая гетерогенность: природа и биологическое значение. Биохимия. 2013;78(11):1531–1549. (Электронный ресурс). URL: https://biochemistrymoscow.com/ru/archive/2013/78-11-1531/ (дата обращения: 03.05.2024).
Любченко Л.Н., Черненко П.А., Хатырев С.А. и др. Клинико-генетическая гетерогенность меланомы кожи. Молекулярно-генетические аспекты диагностики. Злокачественные опухоли. 2012;2(2).
Boussemart L., Nelson A., Wong M., et al. Hybrid Capture-Based Genomic Profiling Identifies BRAF V600 and Non-V600 Alterations in Melanoma Samples Negative by Prior Testing. Oncologist. 2019 May;24(5):657–663. DOI: 10.1634/theoncologist.2018-0271. Epub 2019 Jan 25. PMID: 30683711; PMCID: PMC6516121.
Мутация гена BRAF при меланоме. Официальный сайт Программы RUSSCO. Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения. (Электронный ресурс). URL: http://www.cancergenome.ru/mutations/BRAF/melanoma/ (дата обращения: 03.05.2024).
Churi C.R., Shroff R., Wang Y., et al. Mutation profiling in cholangiocarcinoma: prognostic and therapeutic implications. PLoS One. 2014;9(12):e115383. DOI: 10.1371/journal.pone.0115383. PMID: 25536104; PMCID: PMC4275227.
Louis D.N., Perry A., Reifenberger G., et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol . 2016;131:803–820. https://doi.org/10.1007/s00401-016-1545-1.
Staedtke V., Dzaye O., Holdhoff M. Actionable molecular biomarkers in primary brain tumors. Trends Cancer. 2016 Jul;2(7):338–349. DOI: 10.1016/j.trecan.2016.06.003. PMID: 28603776; PMCID: PMC5461965.
Schwaederle M., Zhao M., Lee J.J., Eggermont A.M., Schilsky R.L., Mendelsohn J., Lazar V., Kurzrock R. Impact of Precision Medicine in Diverse Cancers: A Meta-Analysis of Phase II Clinical Trials. J Clin Oncol. 2015;33(32):3817–3825. DOI: 10.1200/JCO.2015.61.5997. Epub 2015 Aug 24. PMID: 26304871; PMCID: PMC4737863.