Разберемся в алгоритмах лечения рака мочевого пузыря и особенностях применения иммунотерапии.
Иммунотерапия при раке мочевого пузыря
1
Содержание статьи
Системная терапия, как правило, требуется пациентам с местно-распространенной и метастатической стадиями рака мочевого пузыря. Химиотерапия — основной метод лечения при раке мочевого пузыря распространенных стадий. Почему только 50% пациентов с раком мочевого пузыря могут получить терапию на основе цисплатина? При непереносимости цисплатина или препаратов платины может применяться иммунотерапия. В каких случаях при раке мочевого пузыря могут назначить иммунотерапию? Какие лабораторные анализы сдают перед назначением иммунотерапии?
Тактика лечения рака мочевого пузыря (РМП) зависит от стадии заболевания, от того, насколько далеко могли распространиться опухолевые клетки от первоначального очага. Если опухоль не выходит за границы мочевого пузыря, то лучший результат принесет операция по удалению пораженного участка или органа целиком. Но если велика вероятность появления метастазов, врачи назначают системную химиотерапию или иммунотерапию, которые уничтожают опухолевые клетки во всем организме.
Системная терапия, как правило, требуется пациентам с местно-распространенной и метастатической стадиями рака мочевого пузыря.
РМП не любит скрываться, специфичные симптомы, такие как кровь в моче, боли при мочеиспускании, частые походы в туалет, обычно появляются рано и заставляют обратиться к врачу. Поэтому в подавляющем большинстве случаев заболевание выявляется на ранних стадиях, когда основным методом лечения является хирургическая операция. Только в 9% случаев врачи диагностируют болезнь уже на IV стадии и начинают лечение сразу с системной терапии1.
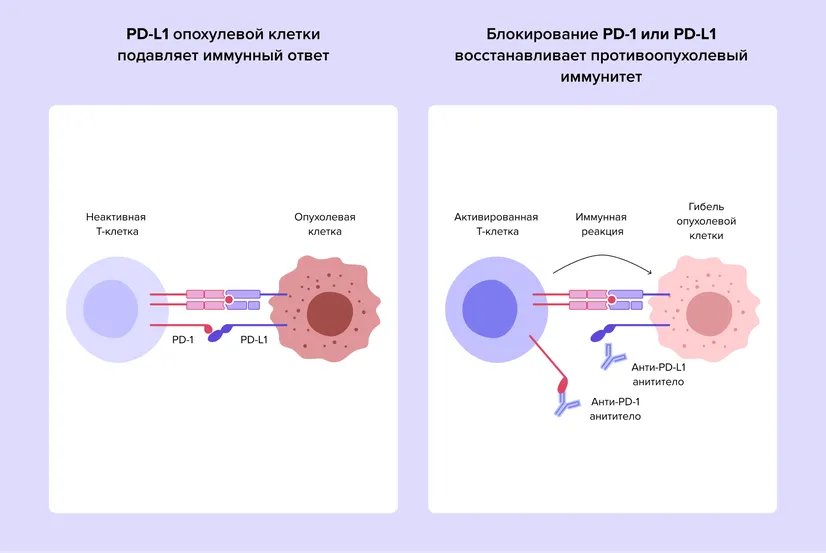
У 33% пациентов врачи диагностируют РМП на II и III стадиях. В таких случаях основным методом лечения бывает радикальная цистэктомия — удаление мочевого пузыря с прилегающими тканями и ближайшими лимфоузлами. Несмотря на большой объем операции и сопутствующую периоперационную терапию, направленную на борьбу с микрометастазами (адъювантную и неоадъювантную терапии), как правило, рак не удается излечить до конца. Рецидив — возвращение заболевания — происходит у 50% пациентов в течение 5 лет после операции2. Новая опухоль может развиваться в малом тазу — в районе удаленного мочевого пузыря, но чаще возникают отдаленные метастазы в костях, печени и легких3. В этой ситуации требуется широкое воздействие на опухоль, а значит, применяют системные методы лечения, такие как химиотерапия и иммунотерапия.
Рис 1. Места частой локализации очагов метастазирования при РМП
Химиотерапия — основной метод лечения при раке мочевого пузыря распространенных стадий.
Традиционным и самым эффективным способом системной терапии РМП является химиотерапия на основе препаратов платины. Врачи называют ее золотым стандартом первой линии, так как именно с нее рекомендуется начинать лечение4. Препараты платины вызывают цитостатический эффект — они нарушают структуру ДНК делящихся клеток и вызывают их гибель. Наибольшую распространенность получили два препарата — цисплатин и карбоплатин, которые применяются уже более 30 лет для лечения большинства онкологических заболеваний. Сегодня онкологи применяют их в комплексе с другими препаратами в так называемых схемах терапии. При РМП наибольшую эффективность показывает именно химиотерапия на основе цисплатина, которая активно подавляет опухолевые клетки, увеличивая продолжительность жизни пациента.
Почему только 50% пациентов с раком мочевого пузыря могут получить терапию на основе цисплатина?
Несмотря на высокую эффективность цисплатина, его применение ограничено из-за токсичности и высокой частоты развития нежелательных явлений.
Поражение почек
Происходит у 15–35% пациентов. Цисплатин выводится из организма через почки, где в результате этого создается его повышенная концентрация, и он поражает здоровые клетки. Происходит повышение уровня креатинина в крови, снижение количества отделяемой мочи и т. д. Для того чтобы уменьшить токсическое влияние на почки, во время химиотерапии проводят интенсивную гидратацию — внутривенно вводят большие объемы жидкости (2–3 литра раствора). В результате повышается мочеотделение, и препарат вымывается из ткани почек. Введение таких объемов жидкости может быть противопоказано, если имеются сопутствующие заболевания, например при сердечной недостаточности.

Нейротоксичность
Цисплатин может поражать периферические нервные волокна и ганглии, вызывая нарушение чувствительности и парестезии. Чаще всего нарушения проходят после окончания терапии, но у 10–20% пациентов сохраняется невропатический болевой синдром.

Тошнота и рвота
Возникают у 90% пациентов, быстро развиваются и вызывают значимое снижение качества жизни4, 5.
Цисплатин не применяют, если врач понимает, что пациент не перенесет терапию из-за тяжелого общего состояния, вызванного онкологическим процессом, или наличия сопутствующих заболеваний. Противопоказаниями к применению являются6, 7:
- Общее тяжелое состояние пациента (ECOG >2).
- Нарушение функции почек, о котором можно судить по снижению клиренса креатинина (<60 мл/мин).
- Невозможность проведения гипергидратации из-за сопутствующих заболеваний.
- Нарушение слуха.
- Сердечная недостаточность при определенных стадиях.
- Нарушение костномозгового кроветворения.
При невозможности применения цисплатина врач может назначить химиотерапию на основе карбоплатина или, при наличии дополнительных маркеров, например высокой экспрессии PD-L1, — иммунотерапию.
При непереносимости цисплатина или препаратов платины может применяться иммунотерапия.
Как работает иммунотерапия при раке мочевого пузыря?
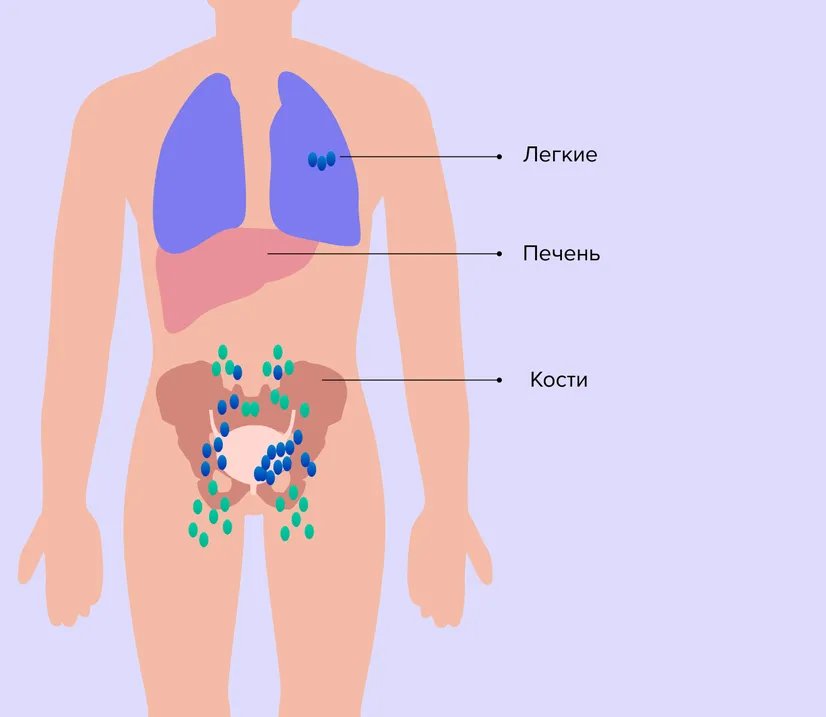
Мутации, приводящие к нарушению роста и деления клеток, происходят постоянно, но благодаря иммунной системе такие сбои не приводят к развитию рака. Одной из причин возникновения онкологических заболеваний становится способность опухолевых клеток скрываться от иммунного надзора. Это может осуществляться через механизм рецептора программируемой клеточной смерти (PD-1). Рецептор PD-1 присутствует на иммунных Т-клетках и может отключать их активность, когда встречается со своим партнером — лигандом (PD-L1) на макрофагах и дендритных клетках, также являющихся частью иммунитета. Этот сложный механизм нужен для саморегуляции иммунной системы и предотвращения развития аутоиммунных процессов8.
Опухолевые клетки также научились вырабатывать PD-L1 на своей поверхности, с помощью него они сообщают Т-клеткам о своей неприкосновенности и уходят из-под действия иммунитета.
Чтобы восстановить работу иммунитета и помочь организму бороться с опухолевыми клетками, были разработаны препараты, блокирующие этот механизм.
В зависимости от места блокирования различают 2 класса препаратов:
- ингибиторы PD-1;
- ингибиторы PD-L1.
Обе группы препаратов могут применяться для системной терапии при РМП распространенных стадий.
Рис. 2. Механизм активации противоопухолевого иммунитета ингибиторами PD-1/PD-L1
Иммунотерапия при ряде онкологических заболеваний показала лучшую эффективность и безопасность по сравнению с химиотерапией. Однако при РМП химиотерапия на основе цисплатина продолжает оставаться наиболее эффективным методом лечения.
В каких случаях при раке мочевого пузыря могут назначить иммунотерапию?
Иммунотерапию ингибиторами PD-1/PD-L1 назначают при РМП IV стадии в следующих случаях6, 9:
- При невозможности проведения цисплатинсодержащей химиотерапии, в случаях когда опухоль или иммунные клетки в ее окружении экспрессируют высокое число рецепторов PD-L1.
- При невозможности применения и цисплатина, и карбоплатина в составе химиотерапии независимо от наличия PD-L1 в опухоли.
- При прогрессировании заболевания у пациента, получавшего химиотерапию в первой линии лечения вне зависимости от наличия PD-L1 в опухоли.
Какие лабораторные анализы сдают перед назначением иммунотерапии?
Определить, экспрессируют ли клетки PD-L1, можно с помощью иммуногистохимического исследования. Сейчас этот метод доступен, и его выполняют во многих лечебных учреждениях. Для анализа потребуется образец опухоли, полученный во время операции или биопсии.
Определять статус PD-L1 для назначения иммунотерапии требуется, только если у пациента из-за тяжести состояния есть непереносимость цисплатина.
При непереносимости всей группы платиносодержащих препаратов или после прогрессирования на химиотерапии, иммунотерапия является эффективной опцией лечения. В таких случаях перед ее назначением исследование уровня PD-L1 в опухоли не проводят.
M-RU-00012403 Июнь 2023
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Каприн А.Д. и др. Состояние онкологической помощи населению России в 2021 году. Москва, 2022.
Gilligan T.D., et al. Muscle-invasive bladder cancer. Holland-Frei Cancer Medicine. 6th edition. BC Decker, 2003.
Shinagare A.B., et al. Metastatic pattern of bladder cancer: correlation with the characteristics of the primary tumor. American Journal of Roentgenology. 2011;196(1):117—122.
Громова Е.Г. и др. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов. Злокачественные опухоли. 2021;11(3S2-2):132—144.
Desilets A., Adam J.P., Soulières D. Management of cisplatin-associated toxicities in bladder cancer patients. Current Opinion in Supportive and Palliative Care. 2020;14(3):286—292.
Клинические рекомендации Минздрава РФ. Рак мочевого пузыря. 2020.
ГРЛС. Инструкция по медицинскому применению лекарственного препарата «Цисплатин».
Zhang Y., Zhang Z. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cellular & molecular immunology. 2020;17(8):807—821.
Nadal R., Bellmunt J. Management of metastatic bladder cancer. Cancer treatment reviews. 2019;76:10—21.
РМП не любит скрываться, специфичные симптомы, такие как кровь в моче, боли при мочеиспускании, частые походы в туалет, обычно появляются рано и заставляют обратиться к врачу. Поэтому в подавляющем большинстве случаев заболевание выявляется на ранних стадиях, когда основным методом лечения является хирургическая операция. Только в 9% случаев врачи диагностируют болезнь уже на IV стадии и начинают лечение сразу с системной терапии1.
У 33% пациентов врачи диагностируют РМП на II и III стадиях. В таких случаях основным методом лечения бывает радикальная цистэктомия — удаление мочевого пузыря с прилегающими тканями и ближайшими лимфоузлами. Несмотря на большой объем операции и сопутствующую периоперационную терапию, направленную на борьбу с микрометастазами (адъювантную и неоадъювантную терапии), как правило, рак не удается излечить до конца. Рецидив — возвращение заболевания — происходит у 50% пациентов в течение 5 лет после операции2. Новая опухоль может развиваться в малом тазу — в районе удаленного мочевого пузыря, но чаще возникают отдаленные метастазы в костях, печени и легких3. В этой ситуации требуется широкое воздействие на опухоль, а значит, применяют системные методы лечения, такие как химиотерапия и иммунотерапия.
Рис 1. Места частой локализации очагов метастазирования при РМП
Традиционным и самым эффективным способом системной терапии РМП является химиотерапия на основе препаратов платины. Врачи называют ее золотым стандартом первой линии, так как именно с нее рекомендуется начинать лечение4. Препараты платины вызывают цитостатический эффект — они нарушают структуру ДНК делящихся клеток и вызывают их гибель. Наибольшую распространенность получили два препарата — цисплатин и карбоплатин, которые применяются уже более 30 лет для лечения большинства онкологических заболеваний. Сегодня онкологи применяют их в комплексе с другими препаратами в так называемых схемах терапии. При РМП наибольшую эффективность показывает именно химиотерапия на основе цисплатина, которая активно подавляет опухолевые клетки, увеличивая продолжительность жизни пациента.
Почему только 50% пациентов с раком мочевого пузыря могут получить терапию на основе цисплатина?
Несмотря на высокую эффективность цисплатина, его применение ограничено из-за токсичности и высокой частоты развития нежелательных явлений.

Поражение почек
Происходит у 15–35% пациентов. Цисплатин выводится из организма через почки, где в результате этого создается его повышенная концентрация, и он поражает здоровые клетки. Происходит повышение уровня креатинина в крови, снижение количества отделяемой мочи и т. д. Для того чтобы уменьшить токсическое влияние на почки, во время химиотерапии проводят интенсивную гидратацию — внутривенно вводят большие объемы жидкости (2–3 литра раствора). В результате повышается мочеотделение, и препарат вымывается из ткани почек. Введение таких объемов жидкости может быть противопоказано, если имеются сопутствующие заболевания, например при сердечной недостаточности.

Нейротоксичность
Цисплатин может поражать периферические нервные волокна и ганглии, вызывая нарушение чувствительности и парестезии. Чаще всего нарушения проходят после окончания терапии, но у 10–20% пациентов сохраняется невропатический болевой синдром.

Тошнота и рвота
Возникают у 90% пациентов, быстро развиваются и вызывают значимое снижение качества жизни4, 5.
Цисплатин не применяют, если врач понимает, что пациент не перенесет терапию из-за тяжелого общего состояния, вызванного онкологическим процессом, или наличия сопутствующих заболеваний. Противопоказаниями к применению являются6, 7:
- Общее тяжелое состояние пациента (ECOG >2).
- Нарушение функции почек, о котором можно судить по снижению клиренса креатинина (<60 мл/мин).
- Невозможность проведения гипергидратации из-за сопутствующих заболеваний.
- Нарушение слуха.
- Сердечная недостаточность при определенных стадиях.
- Нарушение костномозгового кроветворения.
При невозможности применения цисплатина врач может назначить химиотерапию на основе карбоплатина или, при наличии дополнительных маркеров, например высокой экспрессии PD-L1, — иммунотерапию.
При непереносимости цисплатина или препаратов платины может применяться иммунотерапия.
Как работает иммунотерапия при раке мочевого пузыря?
Мутации, приводящие к нарушению роста и деления клеток, происходят постоянно, но благодаря иммунной системе такие сбои не приводят к развитию рака. Одной из причин возникновения онкологических заболеваний становится способность опухолевых клеток скрываться от иммунного надзора. Это может осуществляться через механизм рецептора программируемой клеточной смерти (PD-1). Рецептор PD-1 присутствует на иммунных Т-клетках и может отключать их активность, когда встречается со своим партнером — лигандом (PD-L1) на макрофагах и дендритных клетках, также являющихся частью иммунитета. Этот сложный механизм нужен для саморегуляции иммунной системы и предотвращения развития аутоиммунных процессов8.
Опухолевые клетки также научились вырабатывать PD-L1 на своей поверхности, с помощью него они сообщают Т-клеткам о своей неприкосновенности и уходят из-под действия иммунитета.
Чтобы восстановить работу иммунитета и помочь организму бороться с опухолевыми клетками, были разработаны препараты, блокирующие этот механизм.
В зависимости от места блокирования различают 2 класса препаратов:
- ингибиторы PD-1;
- ингибиторы PD-L1.
Обе группы препаратов могут применяться для системной терапии при РМП распространенных стадий.
Рис. 2. Механизм активации противоопухолевого иммунитета ингибиторами PD-1/PD-L1
Иммунотерапия при ряде онкологических заболеваний показала лучшую эффективность и безопасность по сравнению с химиотерапией. Однако при РМП химиотерапия на основе цисплатина продолжает оставаться наиболее эффективным методом лечения.
В каких случаях при раке мочевого пузыря могут назначить иммунотерапию?
Иммунотерапию ингибиторами PD-1/PD-L1 назначают при РМП IV стадии в следующих случаях6, 9:
- При невозможности проведения цисплатинсодержащей химиотерапии, в случаях когда опухоль или иммунные клетки в ее окружении экспрессируют высокое число рецепторов PD-L1.
- При невозможности применения и цисплатина, и карбоплатина в составе химиотерапии независимо от наличия PD-L1 в опухоли.
- При прогрессировании заболевания у пациента, получавшего химиотерапию в первой линии лечения вне зависимости от наличия PD-L1 в опухоли.
Какие лабораторные анализы сдают перед назначением иммунотерапии?
Определить, экспрессируют ли клетки PD-L1, можно с помощью иммуногистохимического исследования. Сейчас этот метод доступен, и его выполняют во многих лечебных учреждениях. Для анализа потребуется образец опухоли, полученный во время операции или биопсии.
Определять статус PD-L1 для назначения иммунотерапии требуется, только если у пациента из-за тяжести состояния есть непереносимость цисплатина.
При непереносимости всей группы платиносодержащих препаратов или после прогрессирования на химиотерапии, иммунотерапия является эффективной опцией лечения. В таких случаях перед ее назначением исследование уровня PD-L1 в опухоли не проводят.
M-RU-00012403 Июнь 2023
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Каприн А.Д. и др. Состояние онкологической помощи населению России в 2021 году. Москва, 2022.
Gilligan T.D., et al. Muscle-invasive bladder cancer. Holland-Frei Cancer Medicine. 6th edition. BC Decker, 2003.
Shinagare A.B., et al. Metastatic pattern of bladder cancer: correlation with the characteristics of the primary tumor. American Journal of Roentgenology. 2011;196(1):117—122.
Громова Е.Г. и др. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов. Злокачественные опухоли. 2021;11(3S2-2):132—144.
Desilets A., Adam J.P., Soulières D. Management of cisplatin-associated toxicities in bladder cancer patients. Current Opinion in Supportive and Palliative Care. 2020;14(3):286—292.
Клинические рекомендации Минздрава РФ. Рак мочевого пузыря. 2020.
ГРЛС. Инструкция по медицинскому применению лекарственного препарата «Цисплатин».
Zhang Y., Zhang Z. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cellular & molecular immunology. 2020;17(8):807—821.
Nadal R., Bellmunt J. Management of metastatic bladder cancer. Cancer treatment reviews. 2019;76:10—21.
Несмотря на высокую эффективность цисплатина, его применение ограничено из-за токсичности и высокой частоты развития нежелательных явлений.

Поражение почек
Происходит у 15–35% пациентов. Цисплатин выводится из организма через почки, где в результате этого создается его повышенная концентрация, и он поражает здоровые клетки. Происходит повышение уровня креатинина в крови, снижение количества отделяемой мочи и т. д. Для того чтобы уменьшить токсическое влияние на почки, во время химиотерапии проводят интенсивную гидратацию — внутривенно вводят большие объемы жидкости (2–3 литра раствора). В результате повышается мочеотделение, и препарат вымывается из ткани почек. Введение таких объемов жидкости может быть противопоказано, если имеются сопутствующие заболевания, например при сердечной недостаточности.

Нейротоксичность
Цисплатин может поражать периферические нервные волокна и ганглии, вызывая нарушение чувствительности и парестезии. Чаще всего нарушения проходят после окончания терапии, но у 10–20% пациентов сохраняется невропатический болевой синдром.

Тошнота и рвота
Возникают у 90% пациентов, быстро развиваются и вызывают значимое снижение качества жизни4, 5.
Цисплатин не применяют, если врач понимает, что пациент не перенесет терапию из-за тяжелого общего состояния, вызванного онкологическим процессом, или наличия сопутствующих заболеваний. Противопоказаниями к применению являются6, 7:
- Общее тяжелое состояние пациента (ECOG >2).
- Нарушение функции почек, о котором можно судить по снижению клиренса креатинина (<60 мл/мин).
- Невозможность проведения гипергидратации из-за сопутствующих заболеваний.
- Нарушение слуха.
- Сердечная недостаточность при определенных стадиях.
- Нарушение костномозгового кроветворения.
При невозможности применения цисплатина врач может назначить химиотерапию на основе карбоплатина или, при наличии дополнительных маркеров, например высокой экспрессии PD-L1, — иммунотерапию.
Как работает иммунотерапия при раке мочевого пузыря?
Мутации, приводящие к нарушению роста и деления клеток, происходят постоянно, но благодаря иммунной системе такие сбои не приводят к развитию рака. Одной из причин возникновения онкологических заболеваний становится способность опухолевых клеток скрываться от иммунного надзора. Это может осуществляться через механизм рецептора программируемой клеточной смерти (PD-1). Рецептор PD-1 присутствует на иммунных Т-клетках и может отключать их активность, когда встречается со своим партнером — лигандом (PD-L1) на макрофагах и дендритных клетках, также являющихся частью иммунитета. Этот сложный механизм нужен для саморегуляции иммунной системы и предотвращения развития аутоиммунных процессов8.
Опухолевые клетки также научились вырабатывать PD-L1 на своей поверхности, с помощью него они сообщают Т-клеткам о своей неприкосновенности и уходят из-под действия иммунитета.
Чтобы восстановить работу иммунитета и помочь организму бороться с опухолевыми клетками, были разработаны препараты, блокирующие этот механизм.
В зависимости от места блокирования различают 2 класса препаратов:
- ингибиторы PD-1;
- ингибиторы PD-L1.
Обе группы препаратов могут применяться для системной терапии при РМП распространенных стадий.
Рис. 2. Механизм активации противоопухолевого иммунитета ингибиторами PD-1/PD-L1
Иммунотерапия при ряде онкологических заболеваний показала лучшую эффективность и безопасность по сравнению с химиотерапией. Однако при РМП химиотерапия на основе цисплатина продолжает оставаться наиболее эффективным методом лечения.
В каких случаях при раке мочевого пузыря могут назначить иммунотерапию?
Иммунотерапию ингибиторами PD-1/PD-L1 назначают при РМП IV стадии в следующих случаях6, 9:
- При невозможности проведения цисплатинсодержащей химиотерапии, в случаях когда опухоль или иммунные клетки в ее окружении экспрессируют высокое число рецепторов PD-L1.
- При невозможности применения и цисплатина, и карбоплатина в составе химиотерапии независимо от наличия PD-L1 в опухоли.
- При прогрессировании заболевания у пациента, получавшего химиотерапию в первой линии лечения вне зависимости от наличия PD-L1 в опухоли.
Какие лабораторные анализы сдают перед назначением иммунотерапии?
Определить, экспрессируют ли клетки PD-L1, можно с помощью иммуногистохимического исследования. Сейчас этот метод доступен, и его выполняют во многих лечебных учреждениях. Для анализа потребуется образец опухоли, полученный во время операции или биопсии.
Определять статус PD-L1 для назначения иммунотерапии требуется, только если у пациента из-за тяжести состояния есть непереносимость цисплатина.
При непереносимости всей группы платиносодержащих препаратов или после прогрессирования на химиотерапии, иммунотерапия является эффективной опцией лечения. В таких случаях перед ее назначением исследование уровня PD-L1 в опухоли не проводят.
M-RU-00012403 Июнь 2023
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Да, было полезно
Нет
Поделиться
Список литературы
Каприн А.Д. и др. Состояние онкологической помощи населению России в 2021 году. Москва, 2022.
Gilligan T.D., et al. Muscle-invasive bladder cancer. Holland-Frei Cancer Medicine. 6th edition. BC Decker, 2003.
Shinagare A.B., et al. Metastatic pattern of bladder cancer: correlation with the characteristics of the primary tumor. American Journal of Roentgenology. 2011;196(1):117—122.
Громова Е.Г. и др. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов. Злокачественные опухоли. 2021;11(3S2-2):132—144.
Desilets A., Adam J.P., Soulières D. Management of cisplatin-associated toxicities in bladder cancer patients. Current Opinion in Supportive and Palliative Care. 2020;14(3):286—292.
Клинические рекомендации Минздрава РФ. Рак мочевого пузыря. 2020.
ГРЛС. Инструкция по медицинскому применению лекарственного препарата «Цисплатин».
Zhang Y., Zhang Z. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cellular & molecular immunology. 2020;17(8):807—821.
Nadal R., Bellmunt J. Management of metastatic bladder cancer. Cancer treatment reviews. 2019;76:10—21.
Иммунотерапию ингибиторами PD-1/PD-L1 назначают при РМП IV стадии в следующих случаях6, 9:
- При невозможности проведения цисплатинсодержащей химиотерапии, в случаях когда опухоль или иммунные клетки в ее окружении экспрессируют высокое число рецепторов PD-L1.
- При невозможности применения и цисплатина, и карбоплатина в составе химиотерапии независимо от наличия PD-L1 в опухоли.
- При прогрессировании заболевания у пациента, получавшего химиотерапию в первой линии лечения вне зависимости от наличия PD-L1 в опухоли.
Определить, экспрессируют ли клетки PD-L1, можно с помощью иммуногистохимического исследования. Сейчас этот метод доступен, и его выполняют во многих лечебных учреждениях. Для анализа потребуется образец опухоли, полученный во время операции или биопсии.
Определять статус PD-L1 для назначения иммунотерапии требуется, только если у пациента из-за тяжести состояния есть непереносимость цисплатина.
При непереносимости всей группы платиносодержащих препаратов или после прогрессирования на химиотерапии, иммунотерапия является эффективной опцией лечения. В таких случаях перед ее назначением исследование уровня PD-L1 в опухоли не проводят.
M-RU-00012403 Июнь 2023
Было полезно?
Мы заботимся о том, чтобы наши материалы содержали актуальную информацию, а также оказывали читателям всю необходимую помощь и поддержку. Сообщите, пожалуйста, была ли эта статья полезна для вас.
Список литературы
Каприн А.Д. и др. Состояние онкологической помощи населению России в 2021 году. Москва, 2022.
Gilligan T.D., et al. Muscle-invasive bladder cancer. Holland-Frei Cancer Medicine. 6th edition. BC Decker, 2003.
Shinagare A.B., et al. Metastatic pattern of bladder cancer: correlation with the characteristics of the primary tumor. American Journal of Roentgenology. 2011;196(1):117—122.
Громова Е.Г. и др. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов. Злокачественные опухоли. 2021;11(3S2-2):132—144.
Desilets A., Adam J.P., Soulières D. Management of cisplatin-associated toxicities in bladder cancer patients. Current Opinion in Supportive and Palliative Care. 2020;14(3):286—292.
Клинические рекомендации Минздрава РФ. Рак мочевого пузыря. 2020.
ГРЛС. Инструкция по медицинскому применению лекарственного препарата «Цисплатин».
Zhang Y., Zhang Z. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cellular & molecular immunology. 2020;17(8):807—821.
Nadal R., Bellmunt J. Management of metastatic bladder cancer. Cancer treatment reviews. 2019;76:10—21.